Алкены
888
Алкены (или олефины) – класс ненасыщенных (непредельных) углеводородов, содержащих двойную связь между атомами углерода. Углероды, которые формируют двойную связь, sp2-гибридизованы. Некоторые представители алкенов отражены в таблице.
| Алкен | Название |
| CH2=CH2 | этилен (этен) |
| CH3-CH=CH2 | пропилен (пропен) |
| CH3-CH=CH-CH3 | бутен-2 |
Для алкенов характерны:
- Высокая реакционная способность за счёт реакций присоединения по двойной связи, которые идут, в основном, по ионному механизму;
- Изомерия углеродного скелета, межклассовая изомерия, изомерия положения двойной связи и цис/транс изомерия.
Химические свойства алкенов
- Реакции присоединения
Водород H2 (реакция гидрирования); галогены Cl2, Br2 (реакция галогенирования); вода H2O (реакция гидратации); галогеноводороды HCl, HBr (реакция гидрогалогенирования) легко присоединяются по двойной связи, при этом происходит разрыв двойной связи. Примеры:
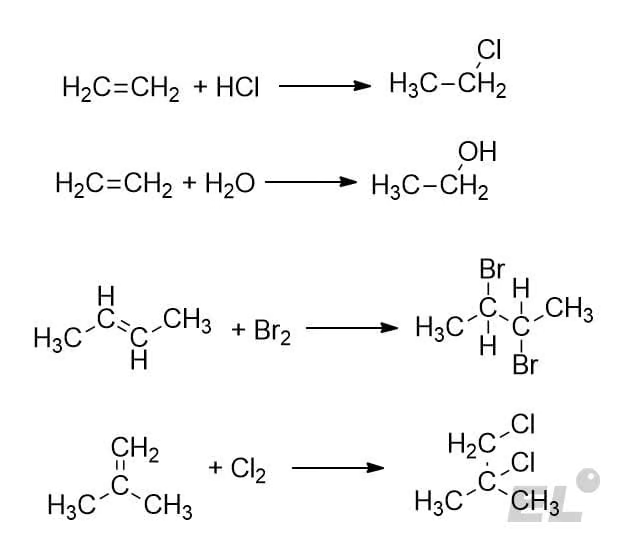
Пока алкен симметричный (типа этилена или бутена-2) или атакующая частица симметрична (двухатомные галогены) никаких сложностей не возникает: рвём двойную связь и добавляем к каждом углероду нужный заместитель. А что делать в таких случаях:
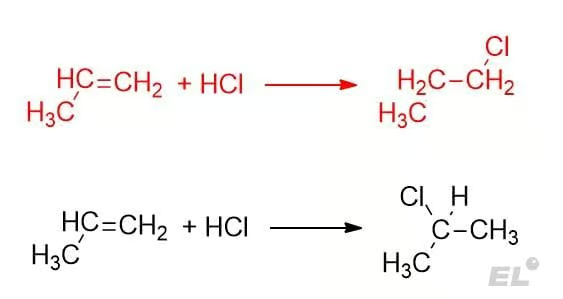
Тут при старой логике возможны два равнозначных продукта. Какой из них будет преобладающий и какой необходимо писать в бланк на экзамене? Ответ на этот вопрос даёт правило Марковникова:
Атом водорода присоединяется к наиболее гидрогенизированному углероду (к углероду, у которого больше атомов водорода)
Поэтому реакция, выделенная красным, цветом неверная – за неё поставят 0 баллов на ЕГЭ, доминирующий продукт 2-хлопропан. Как можно обосновать данное правило?
В пропене метильная группа донирует электронную плотность на двойную связь, в результате пи-связь поляризуется и на концевом атоме углерода формируется небольшой избыток электронов – именно поэтому к нему так хочет состыковаться водород.
Супер, потренируемся на примерах.
1. Бутен-1 + HBr
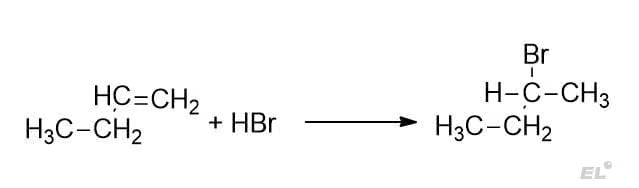
Преобладающий продукт 2-бромпропан (за 1-бромпропан 0 баллов).
2. 2-метилпропен + H2O

Преимущественно образуется третичный спирт.
3. 2-метилбутен-2 + HCl

Доминирующий продукт – третичный алкилхлорид.
Исключения из правила Марковникова (антимарковниковское присоединение)
Как и всегда – в случае правила Марковникова есть исключения. Их немного, всего две штуки, перейдём к ним.
- В молекуле есть электроноакцепторные группы (содержащие электроотрицательные атомы): карбоксильная COOH, трихлорметильная CCl3, трифторметильная CF3, …
Его можно объяснить следующим образом:
Акцепторная группа стягивает электроны с пи-связи и наиболее гидрогенизированный углерод становится самым обеднённым электронной плотностью, поэтому теперь к нему и не идёт водород.
Приведём примеры.
1. Акролеиновая кислота + H2O
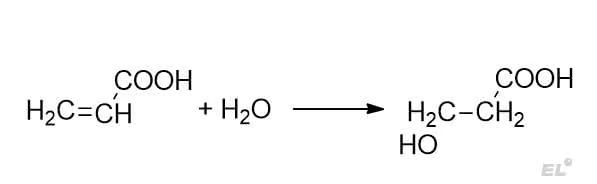
Преимущественно образуется продукт антимарковниковского присоединения. Акцепторная группа – карбоксильная COOH.
2. трихлорпропен + HCl
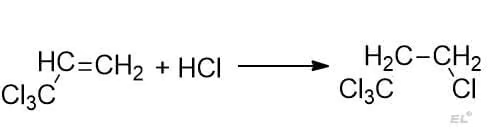
Получается антимарковниковский продукт. Акцепторная группа – трихлорметильная CCl3.
И, наконец, второе исключение.
- В присутствие перекисей (например, H2O2 или органических пероксидов в роде пероксида бензоила) также протекает антимарковниковское присоединение.
Пероксид водорода изменяет механизм присоединения с ионного на радикальный.
Перейдём к примеру: присоединение HBr к пропену с H2O2
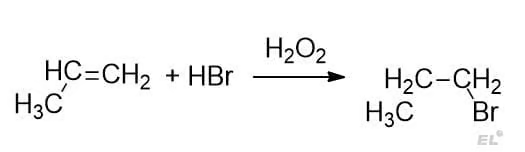
Преимущественно образуется 1-бромпропан.
- Реакции полимеризации
Алкены за счёт раскрытия своей двойной связи могут вступать в реакции полимеризации, то есть формировать последовательность соединённых друг с другом элементарных звеньев (мономеров), генерируя высокомолекулярное соединение – полимер, например, полимеризация этилена даёт полиэтилен:

Число n, показывающее число мономеров в полимере, называется степенью полимеризации.
- Реакции окисления
Реакции окисления алкенов обычно формально делят на мягкое окисление (окисление, которое не разрывает двойную связь полностью, а оставляет «в живых» одинарную связь) – оно идёт при охлаждении, и жёсткое окисление (окисление, которое полностью разрывает двойную связь) – оно идёт при нагревании с сильными окислителями. Характерные примеры таких реакций отражены в таблице (полезно также понимать как уравнивать органические реакции):
| Способ окисления | Пример реакции | Комментарий |
| Мягкое окисление KMnO4 при охлаждении (реакция Вагнера) | 3CH2=CH2 + 2KMnO4 + 4H2O → 3CH2OH-CH2OH + 2MnO2 + 2KOH | Образуется диол (вицинальный двухатомный спирт – гликоль) и бурый осадок диоксида марганца |
| Жёсткое окисление KMnO4 или K2Cr2O7 | 3C6H5CH=CH2 + 5K2Cr2O7 + 20H2SO4 → 3C6H5COOH + 3CO2 + 5Cr2(SO4)3 + 5K2SO4 + 23H2O 5C6H5CH=CHC6H5 + 8KMnO4 + 12H2SO4 → 10C6H5COOH + 4K2SO4 + 8MnSO4 + 12H2O | При окислении в щёлочной среде вместо карбоновых кислот будут соответствующие соли карбоновых кислот. Правила определения продуктов восстановления перманганата и дихромата стандартные из неорганической химии. |
| Вакер-процесс | 2CH2=CH2 + O2 = 2CH3CHO | Катализаторы: CuCl2, PdCl2 |
Способы получения алкенов
- Реакции отщепления (элиминирования): дегидрогалогенирования алкилгалогенидов и внутримолекулярной дегидратации спиртов
Эти способы получения описаны в отдельной статье, посвящённой правилу Зайцева.
- Дегидрирование алканов, гидрирование алкинов
Всё просто: отщепляем водород от алканов, получаем алкены:
CH3-CH2-CH3 = CH3-CH=CH2 + H2
Также можно гидрировать алкины, оставновив гидрирование на алкене с применением отравленных катализаторов:
CH3-C≡CH + H2 = CH3-CH=CH2
(для этого используют отравленные катализаторы – катализаторы, у которых понижена активность за счёт добавок, например, Pt/S, в данном случае сера отравляет платину, сильно понижая её активность).
- Отщепление атомов галогена от вицинальных дигалогеналканов
Эта реакция протекает под действием активных металлов типа цинка или магния, которые забирают атомы галогена, формируя двойную связь:
CH3-CHBr-CH2Br + Zn = CH3-CH=CH2 + ZnBr2
Резюме
- Алкены – класс ненасыщенных углеводородов, имеющих в своём строении двойную связь между атомами углерода;
- Для алкенов очень характерны реакции присоединения, которые управляются правилом Марковникова;
- Существует два исключения из правила Марковникова: перекисное присоединение по Харашу и присоединение по алкенам, в которых есть электроноакцепторные заместители.
Примеры задач на эту тему:
Задание 1. Задача №14 (первая тестовая часть)
Установите соответствие между названием алкена и основным продуктом его взаимодействия с HBr: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
АЛКЕН ПРОДУКТ ГИДРОБРОМИРОВАНИЯ
А) этилен 1) этилбромид
Б) бутен-1 2) бромэтилен
В) бутен-2 3) 2-бромбутан
Г) бутен-1 (кат.: H2O2) 4) 1-бромбутан
5) ацетилен
6) 2-бромпропан
1334
Задание 2. Задача № 16 (первая тестовая часть)
Задана следующая схема превращений веществ:
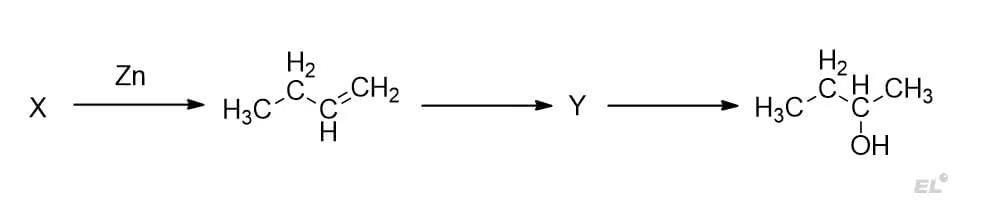
Определите, какие из указанных веществ являются веществами X и Y.
- 2-хлорбутан
- бутанон
- 1,2-дибромбутан
- бутандиол-1
- бутанол-1
31
Задание 3. Задача № 32 (вторая открытая часть)
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Карбид кальция → X1 → Этилен → X2 → X3 → Этилен
- CaC2 + 2H2O → Ca(OH)2 + C2H2
- C2H2 + H2 → C2H4
- C2H4 + HBr → CH3CH2Br
- CH3CH2Br + NaOH (водный) → CH3CH2OH + NaBr
- CH3CH2OH → C2H4 + H2O
Определения:
Термины
- Ненасыщенные (непредельные) соединения – соединения, содержащие кратные связи (двойные, тройные).
- sp2-гибридизованный углерод – углерод, который образует две одинарных связи и одну двойную связь.
- Ионный механизм – механизм, в ходе которого происходит образование промежуточных заряженных частиц (катионов и анионов).
- Изомерия углеродного скелета ярко проявляется, например, в парах CH3CH2CH2-CH=CH2 и (CH3)2CH-CH=CH2.
- Межклассовая изомерия в случае алкенов заключается в том, что алкены изомерны циклоалканам.
- Изомерия положения двойной связи заключается в том, между какими атомами углерода есть двойная связь, примеры: бутен-1 и бутен-2.
- Цис (по одну сторону от двойной связи)/транс (по разные стороны от двойной связи) изомерия заключается в том как друг относительно двойной связи расположены углеводородные заместители в алкене:

- Радикальный механизм – механизм, в ходе которого происходит образование промежуточных радикалов (частиц с одним или несколько неспаренными электронами).
- Статья про уравнивание органических реакций
В 32 и 33 задачах от нас ожидают написать соответственно 5 и 1 реакций (всего 6 реакций) с участием органических веществ. Большинство из этих реакций очень просто уравнять, например, присоединение к алкенам:
CH2=CH2 + HCl = CH3CH2Cl
Тримеризация ацетилена:
3C2H2 = C6H6
Дегидрогалогенирование алкилгалогенидов:
CH3CHBr2 + 2KOH (спирт) = C2H2 + 2KBr + 2H2O
Но, к несчастью для нас, скорее всего хотя бы одна из этих реакций будет окислительно-восстановительной. Это реакции типа:
1) Толуол + KMnO4 (в щёлочной среде)
C6H5CH3 + 6KMnO4 + 7KOH = C6H5COOK + 6K2MnO4 + 5H2O
Поскольку среда сильнощёлочная, то перманганат восстанавливается до манганата калия.
2) Стирол + K2Cr2O7 (в кислой среде)
3C6H5CH=CH2 + 5K2Cr2O7 + 20H2SO4 = 3C6H5COOH + 3CO2 + 5Cr2(SO4)3 + 5K2SO4 + 23H2O
Поскольку среда кислая, то дихромат восстанавливается до соли хрома.
Каким же образом были получены эти страшные коэффициенты? Ответ: они получены с помощью электронного баланса, который нам хорошо знаком с неорганики. В общем-то, все правила, которые используются для баланса из 29 задания (и для неорганических реакций из 31 задания) работают и для органических веществ. Но тут, придётся разобраться, как считать степень окисления у углеродов в органических молекулах. Поскольку степень окисления – вещь сугубо формальная (у неё нет реального физического смысла), мы можем её ввести, как нам удобнее – главное единообразно для всех молекул. Можно, например, ввести следующие правила:
- Связь углерод-углерод не даёт вклада в степень окисления
- Связь углерод-водород даёт -1 к степени окисления углерода
- Каждая связь углерод-более электроотрицательный элемент даёт +1 к степени окисления
Примеры:
- Определим степень окисления у карбонильного углерода в ацетальдегиде CH3CHO: имеется одна связь с углеродом (не даёт вклада, то есть нулевой вклад), одна связь с водород (даёт -1 к степени окисления), двойная связь с кислородом (даёт +2 к степени окисления), итого 0 -1 + 2 = +1. А у углерода метильной группы: 3 связи с водородами (-3 к степени окисления) и одна связь с углеродами (0 к степени окисления), получаем -3 + 0 = -3.

- Рассмотрим муравьиную кислоту HCOOH. Имеем одну связь с водородом (даёт -1) и 3 связи с кислородом (даёт +3), итоговая степень окисления: -1 + 3 = +2.
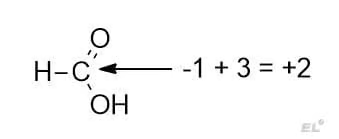
Теперь попробуем уравнять уже написанные две реакции. Начнём с толуола: в ходе окисления затрагивается только метильная группа. В ней у углерода степень окисления равна -3 (одна связь с углеродом даёт 0 и ещё 3 водорода -3). В конечном продукте – бензоате калия, имеем 3 связи с кислородом (+3) и 1 связь с углеродом (даёт 0), степень окисления +3. Перманганат меняет свою степень окисления с +7 до +6. Пишем электронный баланс:
C-3 – 6e = C+3|1| C-3 – восстановитель
Mn+7 + e = Mn+6|6| Mn+7 – окислитель
Отсюда и получаем шестёрку перед KMnO4 и единичку перед толуолом. Перейдём к стиролу: в нём меняется степень окисления у углеродов винильной группы -CH=CH2. Степени окисления -C-1H=C-2H2. Углерод в степени окисления -1 переходит в +3 (COOH), из -2 в +4 (CO2). Хром, в свою очередь, меняет свою степень окисления с +6 на +3. Пишем баланс:
C-1 – 4e = C+3|3| C-1 — восстановитель
C-2 – 6e = C+4|3| C-2 — восстановитель
Cr+6 + 3e = Cr+3|10| Cr+6 – окислитель
Поскольку в K2Cr2O7 два хрома, то ставим перед ним пятёрку, а перед стиролом тройку.
В целом, по сложности на экзамене будут ждать подобные окислительно-восстановительные реакции. Рассмотрим ещё примерчики.
1) Реакция серебряного зеркала
Типичная качественная реакция на альдегидную группу. Например, ацетальдегид + аммиачный раствор оксида серебра:
CH3CHO + 2[Ag(NH3)2]OH = CH3COONH4 + 2Ag + 3NH3 + H2O
Как уже считали выше, у углерода в альдегидной группе степень окисления +1, в карбоксильной группе +3. Серебро меняет свою степень окисления с +1 до 0. Баланс:
C+1 – 2e = C+3|1| C+1 – восстановитель
Ag+1 + e = Ag0|2| Ag+1 – окислитель
Ставим двойку перед аммиачным комплексом и единичку перед ацетальдегидом. Любопытно протекает эта реакция с муравьиным альдегидом (формальдегидом):
CH2O + 4[Ag(NH3)2]OH = (NH4)2CO3 + 4Ag + 6NH3 + 2H2O
В ходе этой реакции первоначально образуется HCOONH4, которая за счёт высокой восстановительной способности, окисляется до углекислого газа, который реагирует с аммиаком, давая карбонат аммония. В формальдегиде степень окисления углерода -2 + 2 = 0, в карбонате аммония +4. Баланс:
C0 – 4e = C+4|1| C0 — восстановитель
Ag+1 + e = Ag0|4| Ag+1 – окислитель
2) Вакер-процесс
Вакер-процесс – одностадийное каталитическое окисление этилена до ацетальдегида:
2CH2=CH2 + O2 = 2CH3CHO
В исходном этилене у каждого углерода степень окисления -2, в ацетальдегиде у углеродов степени окисления -3 (в метильной группе), +1 (в альдегидной группе). Кислород меняет свою степень окисления с 0 до -2. Баланс:
C-2 – 3e = C+1|2| C-2 — восстановитель
C-2 + e = C-3|2| C-2 – окислитель
O20 + 4e = 2O-2|1| O20 – окислитель
В данном случае один из углеродов является окислителем, а другой восстановителем.
3) Реакция Вагнера
Это мягкое окисление двойной связи в нейтральной среде (или слабо щёлочной) при пониженной температуре до вицинальных диолов (гликолей). Например, окисление этилена по Вагнеру даёт этиленгликоль:
3CH2=CH2 + 2KMnO4 + 4H2O = 3CH2OH-CH2OH + 2MnO2 + 2KOH
В конечном этандиоле у каждого углерода степень окисления -2 + 1 = -1. Марганец меняет свою степень окисления с +7 до +4. Баланс:
2C-2 – 2e = 2C-1|3| C-2 — восстановитель
Mn+7 + 3e = Mn+4|2| Mn+7 – окислитель
В ходе этой реакции выпадает бурый осадок диоксида марганца.
4) Жёсткое окисление стильбена
Рассмотрим следующую реакцию:
5C6H5CH=CHC6H5 + 8KMnO4 + 12H2SO4 → 10C6H5COOH + 4K2SO4 + 8MnSO4 + 12H2O
В исходном стильбене степени окисления углерода -1 в фрагменте CH=CH. Стильбен окисляется до бензойной кислоты, то есть углероды переходят в степень окисления +3. Марганец меняет свою степень окисления с +7 до +2. Запишем баланс:
2C-1 – 8e = 2C+3|5| C-1 — восстановитель
Mn+7 + 5e = Mn+2|8| Mn+7 – окислитель
Получаем коэффициент 5 перед стильбеном, 8 перед марганцовкой.
10. Напомним правила насчёт восстановления перманганата калия и дихромата калия в разных средах (кислой, нейтральной и щёлочной):
- KMnO4: в кислой среде восстановление идёт до соли марганца со степенью окисления +2, цвет раствора при этом меняется с фиолетового (KMnO4) на бесцветный (соль марганца).
- KMnO4: в сильнощёлочной среде восстановление идёт до манганата калия K2MnO4, где у марганца степень окисления +6. Раствор меняет окраску с фиолетового (KMnO4) на зелёный (K2MnO4).
- KMnO4: в нейтральной среде восстановление идёт до пиролюзита (диоксида марганца) MnO2 (марганец +4). Пиролюзит – бурый (чёрный) осадок.
- дихроматы имеют оранжевую окраску раствору и устойчивы в кислой среде, хроматы имеют жёлтую окраску и устойчивы в щёлочной среде.
- K2Cr2O7: в кислой среде восстановление идёт до солей хрома в степени окисления +3. Окраска меняется на зелёную (соли хрома).
- K2Cr2O7: в щёлочной среде образуется комплексная соль K3[Cr(OH)6] зелёного цвета (степень окисления хрома +3).
- K2Cr2O7: в нейтральной среде образуется зелёный осадок гидроксида хрома (степень окисления хрома +3).
10. Статья про правило Зайцева
Для галогеналканов характерны реакции дегидрогалогенирования под действием спиртовой щёлочи:
CH3CH2Cl + KOH (спирт) = CH2=CH2 + KCl + H2O
А для спиртов реакции дегидратации внутримолекулярной:
CH3CH2OH = CH2=CH2 + H2O
Или межмолекулярной:
2CH3CH2OH = CH3CH2OCH2CH3 + H2O
И в таких реакциях также возникает определённая неоднозначность. Например, в следующих реакциях – непонятно, от какого углерода будет отщепляться протон:
CH3CH2CHBrCH3 + KOH (спирт) = CH3CH2CH=CH2 + KBr + H2O
CH3CH2CHBrCH3 + KOH (спирт) = CH3CH=CHCH3 + KBr + H2O
CH3CH2CHOHCH3 = CH3CH2CH=CH2 + H2O
CH3CH2CHOHCH3 = CH3CH=CHCH3 + H2O
Ответ на этот вопрос – даёт правило Зайцева:
Водород в реакциях дегидратации/дегидрогалогенирования (в реакциях отщепления/элиминирования) отщепляется от наименее гидрогенезированного атома углерода.
Или в другой формулировке:
Водород в реакциях дегидратации/дегидрогалогенирования (в реакциях отщепления/элиминирования) отщепляется таким образом, чтобы образовался наиболее замещённый алкен.
Из второй формулировки легко объяснить правило Зайцева:
В ходе реакций отщепления образуется наиболее стабильный алкен – наиболее замещённый алкен.
Поэтому красным цветом выделены неправильные реакции, за которые поставят 0 баллов. Потренируемся на примерах.
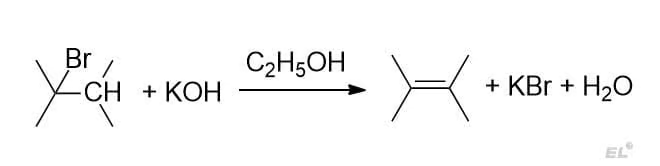
1. Третичный алкилбромид + спиртовой раствор щёлочи
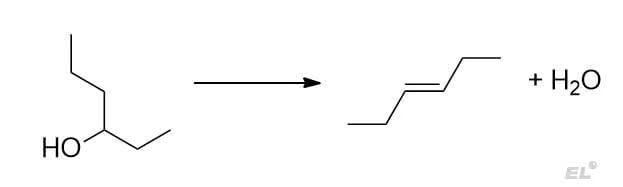
2. Внутримолекулярная дегидратация гексанола-3
Тут проще использовать вторую формулировку с образованием наиболее замещённого алкена.

Хочешь начать готовиться, но остались вопросы?
Заполни форму, и мы подробно объясним, как устроена подготовка к ЕГЭ и ОГЭ в ЕГЭLAND















