Альдегиды и кетоны
985
Альдегиды и кетоны – кислородсодержащие карбонильные соединения. Ключевая особенность данного класса соединений это наличие полярной карбонильной группы C=O с двойной связью между углеродом и кислородом:
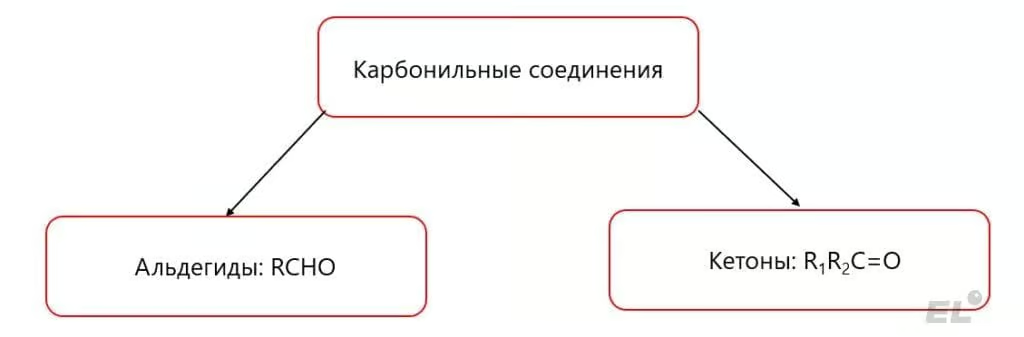
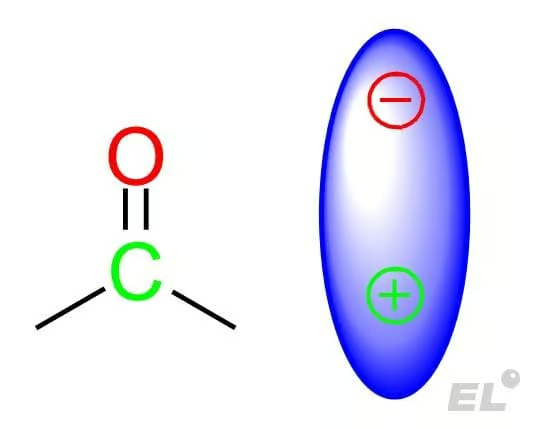
Эту группу можно рассматривать как электрический диполь: с избытком электронов (отрицательным зарядом) на кислороде и недостатком электронов на углероде (положительным зарядом). Стоить обратить внимание:
- Углерод, связанный с кислородом напрямую, sp2-гибридизован, что обеспечивает, например, плоское строение простейшего альдегида формальдегида CH2O (это задание было на ЕГЭ 2023 года по химии);
- В виду полярности группы C=O для карбонильных соединений характерны реакции присоединения;
- Для карбонильных соединений характерна изомерия углеродного скелета, изомерия положения C=O фрагмента и межклассовая изомерия между альдегидами и кетонами.
Некоторые представители альдегидов и кетонов представлены в таблице.
| Карбонильное соединение | Название |
| CH2O | Формальдегид (метаналь) |
| CH3CHO | Ацетальдегид (этаналь) |
| (CH3)2CO | Ацетон (пропанон) |
Химические свойства
- Реакции присоединения
Их все можно описать общей схемой реакции:
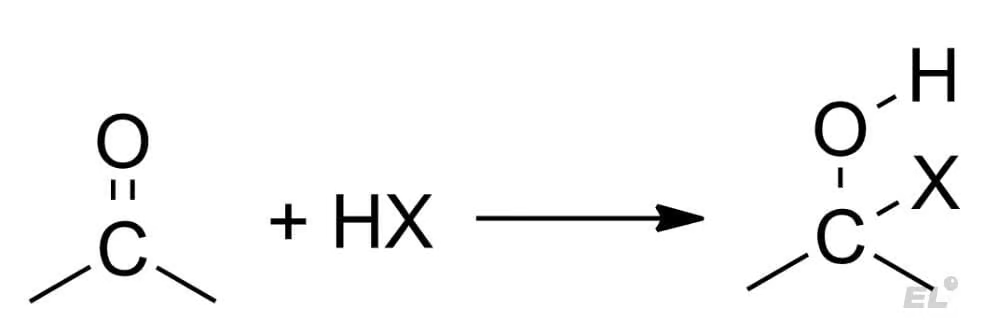
В данном случае X несёт избыток электроном и идёт к положительному концу диполя: углероду, а H с недостатком электроном идёт к кислороду – отрицательному концу диполя. Характерные HX и продукты присоединения HX к карбонильным соединениям представлены в таблице.
| Альдегид/кетон | HX | Продукт |
Бензальдегид 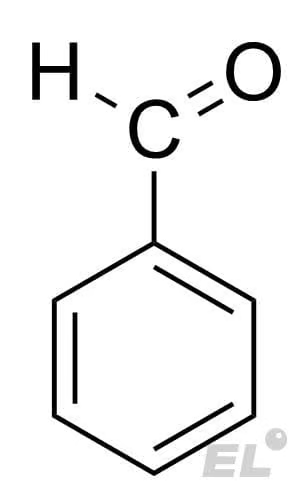 |
H2 (гидрирование) | 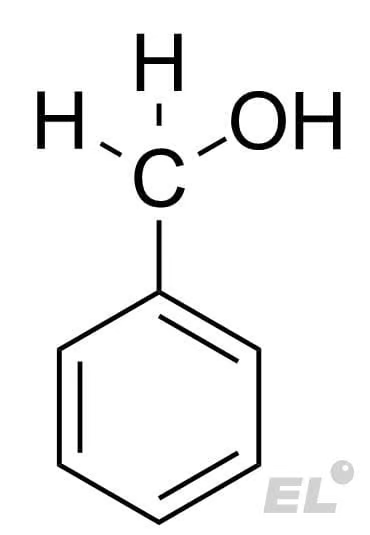 |
| Формальдегид CH2O | H2O (гидратация) | Гидрат формальдегида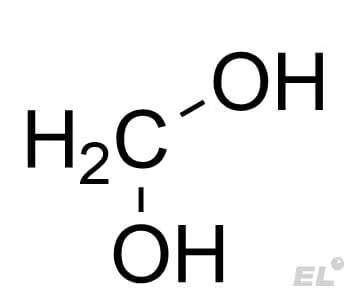 |
| Ацетальдегид CH3CHO | CH3OH | Полуацеталь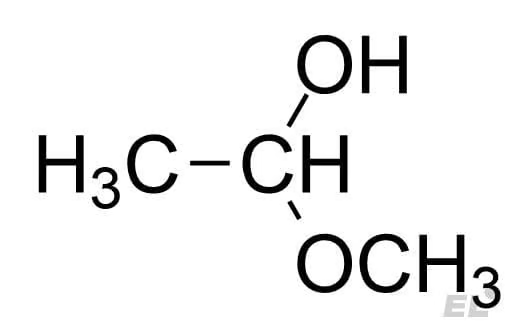 |
Циклопентанон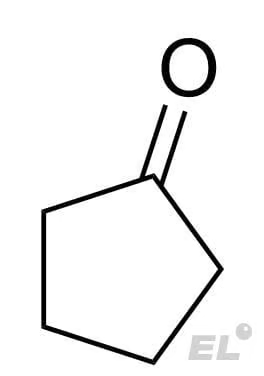 |
HCN (синильная кислота) | Циангидрин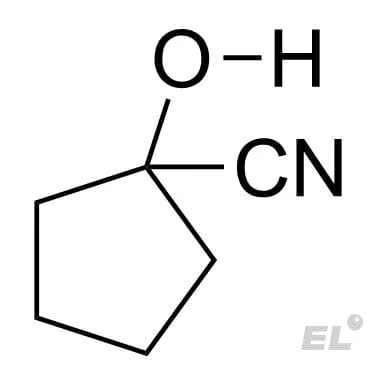 |
| Пропаналь CH3CH2CHO | NaHSO3 | Качественная реакция на альдегидную группу – выпадает осадок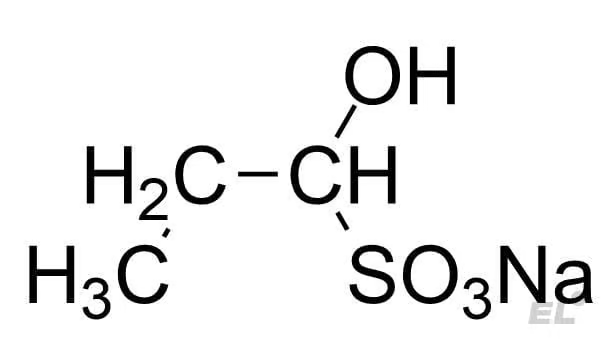 |
- Реакции окисления карбонильной группы
Карбонильную группу в альдегидах можно окислить до карбоксильной группы COOH. Кетоны, в свою очередь, окисляются неселективно, то есть образуется смесь продуктов. Основные способы окисления альдегидов представлены в таблице:
| Способ окисления | Пример реакции | Комментарий |
| Реакция серебряного зеркала | CH3CHO + 2[Ag(NH3)2]OH = CH3COONH4 + 2Ag + 3NH3 + H2O С формальдегидом в виду его повышенных восстановительных способностей реакция идёт по-другому: CH2O + 4[Ag(NH3)2]OH = (NH4)2CO3 + 4Ag + 6NH3 + 2H2O | Качественная реакция на альдегиды – выпадает осадок серебра |
| Окисление свежеосаждённым Cu(OH)2 | CH3CHO + 2Cu(OH)2 = CH3COOH + Cu2O + 2H2O | Качественная реакция на альдегиды – выпадает кирпичный осадок Cu2O |
| Жёсткое окисление KMnO4 или K2Cr2O7 | 5CH3CHO + 2KMnO4 + 3H2SO4 = 5CH3COOH + 2MnSO4 + K2SO4 + 3H2O | Продукты восстановления перманганата и дихромата определяются средой |
| Окисление бромной и хлорной водой | CH3CHO + Br2 + H2O = CH3COOH + 2HBr | Обесцвечивание бромной воды – качественная реакция на альдегиды |
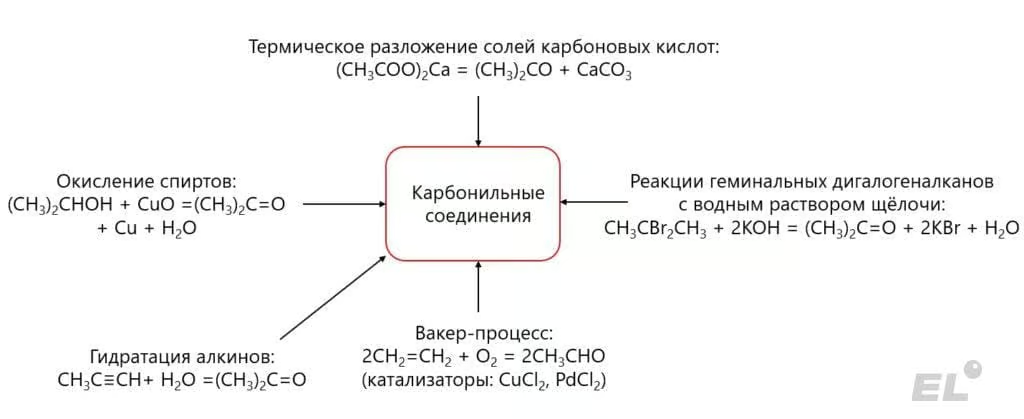
Основные способы получения карбонильных соединений проиллюстрированы следующей схемой:
Резюме
- Альдегиды и кетоны – класс кислород содержащих карбонильных соединений, несущих в своём составе карбонильную группу C=O;
- Карбонильная группа полярная и ведёт себя как диполь с положительным центром на углероде, а отрицательным на кислороде, что обеспечивает реакции присоединения по карбонильной группе;
- Реакция серебряного зеркала – качественная реакция, позволяющая идентифицировать альдегидную группу;
- Для карбонильных соединений характерны реакции присоединения и реакции окисления.
Примеры задач на эту тему:
Задание 1. Задача №11 (первая тестовая часть)
Из предложенного перечня выберите два вещества, молекулы которых плоские:
- формальдегид
- н-гексан
- бензол
- циклогексан
- изобутан
13
Задание 2. Задача № 13 (первая тестовая часть)
Из предложенного перечня выберите два вещества, с которыми реагирует как ацетальдегид, так и пропаналь.
- [Ag(NH3)2]OH
- Br2 (водный)
- NaCl
- диэтиловый эфир
- Na
12
Задание 3. Задача № 32 (вторая открытая часть)
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
CH2=CHBr → X1 → X2 → C2H7NO2 → X3 → метан
- CH2=CHBr + HBr → CH3-CHBr2
- CH3-CHBr2 + 2KOH → CH3CHO + 2KBr + H2O
- CH3CHO + 2[Ag(NH3)2]OH → CH3COONH4 + 2Ag + 3NH3 + H2O
- CH3COONH4 + NaOH → CH3COONa + NH3 + H2O
- CH3COONa + NaOH → Na2CO3 + CH4
Определения:
Термины
- Карбонильные соединения – класс кислородсодержащих органических соединений, имеющих в своём составе группу C=O (карбонильную группу).
- sp2-гибридизованный углерод – углерод, который образует две одинарных связи и одну двойную связь.
- Изомерия углеродного скелете ярко проявляется, например, в парах CH3CH2CH2-CHO и (CH3)2CH-CHO.
- Изомерия положения карбонильной группы определятся тем, у какого атома углерода находится карбонильная группа, примеры: пентанон-2 CH3COCH2CH2CH3 и пентанон-3 CH3CH2COCH2CH3.
- Межклассовая изомерия: например, ацетон (CH3)2CO изомерен пропаналю CH3CH2CHO.
- Напомним правила насчёт восстановления перманганата калия и дихромата калия в разных средах (кислой, нейтральной и щёлочной):
- KMnO4: в кислой среде восстановление идёт до соли марганца со степенью окисления +2, цвет раствора при этом меняется с фиолетового (KMnO4) на бесцветный (соль марганца).
- KMnO4: в сильнощёлочной среде восстановление идёт до манганата калия K2MnO4, где у марганца степень окисления +6. Раствор меняет окраску с фиолетового (KMnO4) на зелёный (K2MnO4).
- KMnO4: в нейтральной среде восстановление идёт до пиролюзита (диоксида марганца) MnO2 (марганец +4). Пиролюзит – бурый (чёрный) осадок.
- дихроматы имеют оранжевую окраску раствору и устойчивы в кислой среде, хроматы имеют жёлтую окраску и устойчивы в щёлочной среде.
- K2Cr2O7: в кислой среде восстановление идёт до солей хрома в степени окисления +3. Окраска меняется на зелёную (соли хрома).
- K2Cr2O7: в щёлочной среде образуется комплексная соль K3[Cr(OH)6] зелёного цвета (степень окисления хрома +3).
- K2Cr2O7: в нейтральной среде образуется зелёный осадок гидроксида хрома (степень окисления хрома +3).

Хочешь начать готовиться, но остались вопросы?
Заполни форму, и мы подробно объясним, как устроена подготовка к ЕГЭ и ОГЭ в ЕГЭLAND











