Обратная связь
Была ли эта статья тебе полезной?
Всё ли было понятно? Оставляй обратную связь, мы это ценим
Не трать свое время на поиски нужной инфы, пользуйся нашим учебником.
Наш мир состоит из маленьких «кирпичиков» – атомов, которые образуют разнообразные вещества. Атом включает в свой состав положительно-заряженное ядро и отрицательно-заряженные электроны:
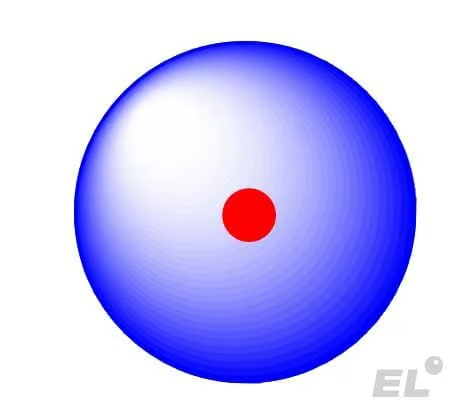
Наглядная модель атома: в центре находится маленькое ядро (красный шарик), в котором сконцентрирована практически вся масса атома (масса ядра в ~2000 раз больше массы элетрона), а вокруг него размазаны электроны в виде синего облака.
Ядро, в свою очередь, состоит из нуклонов: положительно-заряженных протонов и нейтральных нейтронов. Причём поскольку атом нейтральная частица, то число протонов равно числу электронов.
Итак, перейдём к более конкретному описанию атомов химических элементов. Каждый химический элемент характеризуется:
Все данные свойства атомов химических элементов удобно собраны в периодической таблице Менделеева:
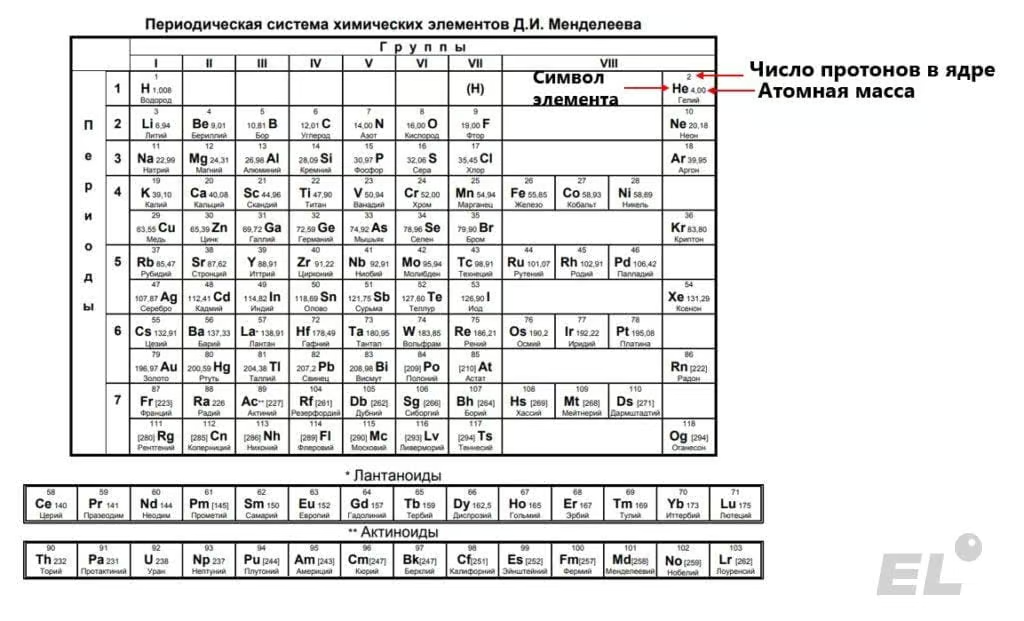
Таблица Менделеева (вид как на ЕГЭ). Её особенности показаны на примере гелия.
Пример: возьмём атом гелия He. Его порядковый номер равен двум, то есть в его ядре находится 2 протона, и, как следствие, два электрона есть в данном атоме. Найдём число нейтронов в ядре атома гелия как разность между атомной массой и числом протонов: 4 – 2 = 2 нейтрона.
Перейдём к описанию электронов в атомах. Для описания состояния электронов в атоме необходимо задать:
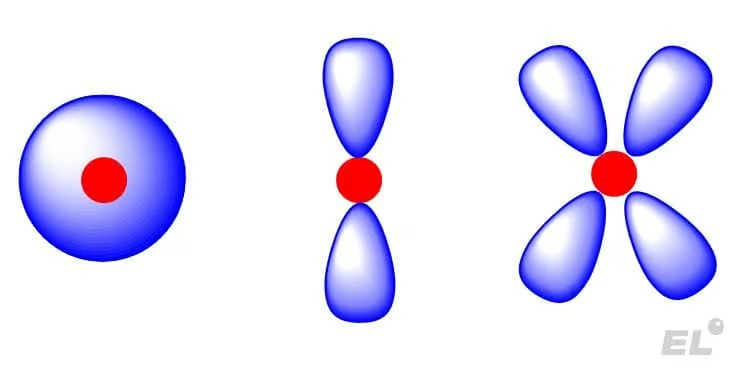
Формы s, p, d-орбиталей (слева направо). Красным шариком показано ядро атома, синий цвет показывает область пространства, где может быть электрон.

Орбиталь, заполненная двумя электронами
При составлении электронных конфигураций необходимо руководствоваться некоторыми правилами. Пройдёмся по ним:

Принцип Паули
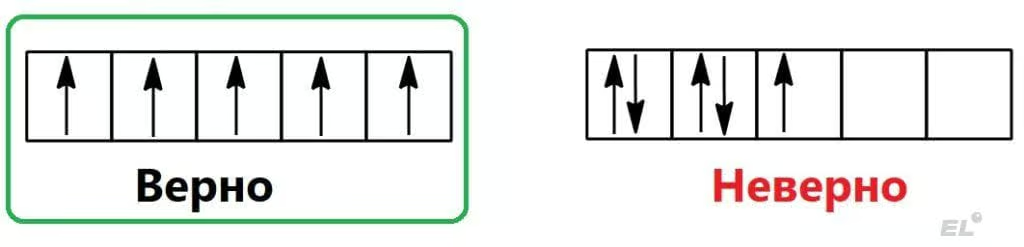
Правило Хунда
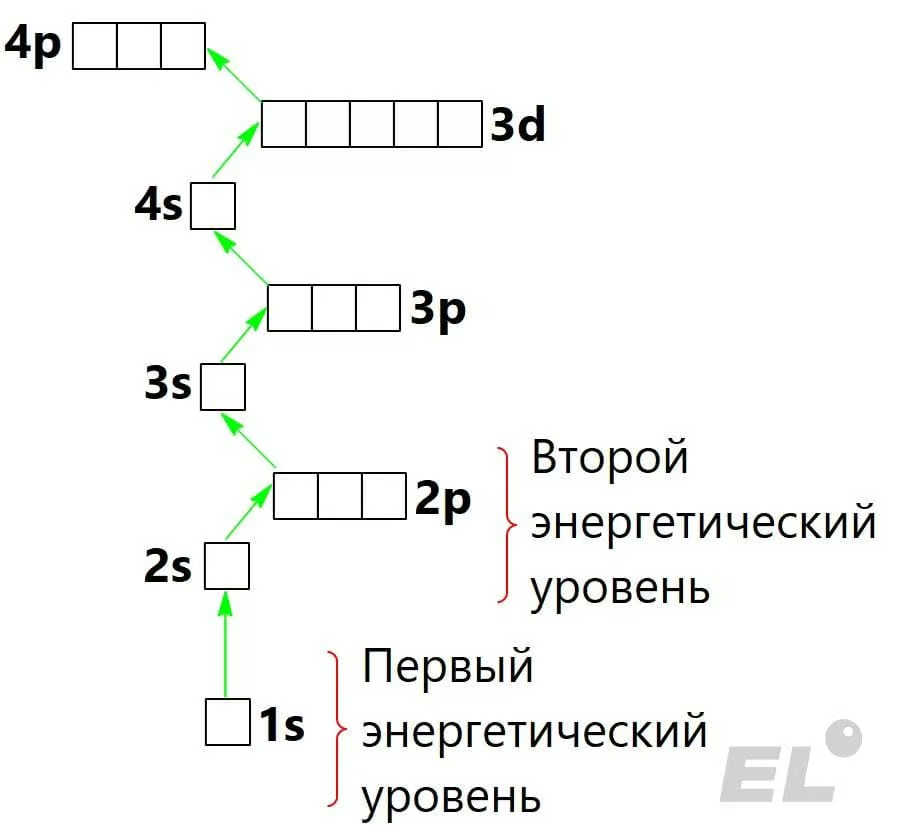
Порядок заполнения орбиталей
Очень важно понимать следующие утверждения:
В заполнении электронных конфигураций может сильно помочь таблица Менделеева:
Пример: возьмём атом фтора. Он находится во втором периоде, то есть имеем два энергетических уровня для заполнения: 1s 2s 2p. Порядковый номер фтора равен 9, то есть необходимо раскидать по этим орбиталям 9 электронов:
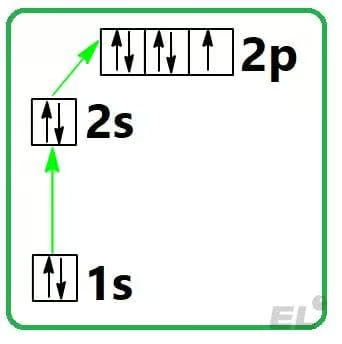
Электронная конфигурация атома фтора
Обычно это записывают, указывая верхним индексом сколько электронов занимает соответствующий подуровень 1s2 2s2 2p5. Поскольку последний заполненный подуровень 2p, то фтор считается p-элементом. В данном случае:
Особенности электронного строения атомов d-элементов
Для того, чтобы понять какие сложности возникают с атомами d-элементов, рассмотрим два поучительных примера:
Все правила, которые были сформулированы выше относятся именно к основным состояниям атомов. Например, у атома серы электронная конфигурация основного состояния 1s2 2s2 2p6 3s2 3p4 (третий период – 3 энергетических уровня, шестая группа – 6 валентных электронов). Мы можем, например, перенести один из электронов с 3p-подуровня на 3d: 1s2 2s2 2p6 3s2 3p3 3d1 – такое состояние будет иметь более высокую энергию и называется возбуждённым.
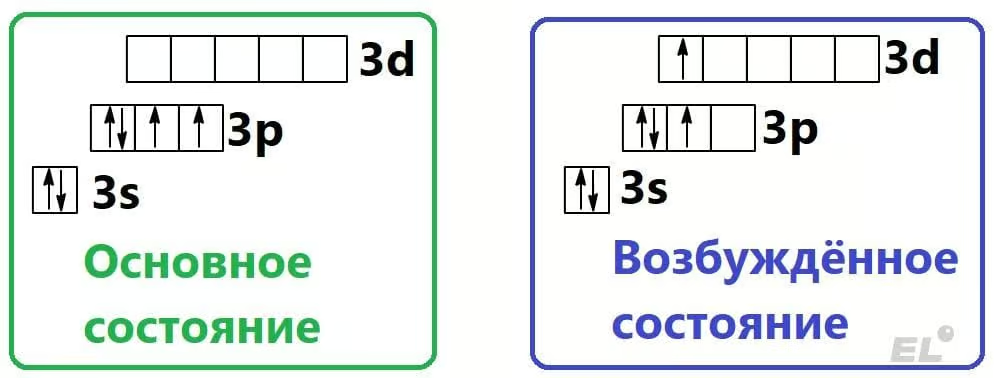
Основное состояние 1s2 2s2 2p6 3s2 3p4 и возбуждённое состояние 1s2 2s2 2p6 3s2 3p3 3d1 атома серы
Возьмём атом и заберём у него один или несколько электронов, он станет положительно-заряженной частицей – катионом. Если наоборот дать атому несколько электронов, то он станет отрицательно-заряженной частицей – анионом. Как строить конфигурации катионов и анионов, зная конфигурацию исходного атома? Очень просто, используем следующие правила:
Резюме
При составлении электронных конфигураций d-элементов стоит помнить про различие внешних и валентных электронов, а также не забывать про явление электронного провала.
Задание 1. Задача №1 (первая часть)
Для решения задания используйте следующий ряд химических элементов:
1) N 2) Na 3) Cr 4) O 5) C
Выберите два элемента, которые имеют ровно один внешний электрон в основном состоянии
2 3
Задание 2. Задача №3 (первая часть)
Для решения задания используйте следующий ряд химических элементов:
1) N 2) Li 3) F 4) Se 5) C
Выберите два элемента, которые проявляют максимальную валентность, равную IV.
14
Задание 3. Задача №28 (первая часть)
При взаимодействии 60 г Na2SO3 с соляной кислотой выделилось 8,96 л (н.у.) диоксида серы. Вычислите массовую долю (в %) примесей в указанном сульфите. (Запишите число с точностью до целых в процентах)
16
Была ли эта статья тебе полезной?
Всё ли было понятно? Оставляй обратную связь, мы это ценим
Тогда заполняй все поля и жди сообщения от нашего менеджера из отдела заботы



Обязательно заполните все поля, иначе мы не сможем точно подобрать подготовку