Обратная связь
Была ли эта статья тебе полезной?
Всё ли было понятно? Оставляй обратную связь, мы это ценим
Не трать свое время на поиски нужной инфы, пользуйся нашим учебником.
Задумывались ли вы, что происходит с твёрдой солью, когда вы её растворяется в воде? Давайте ответим на этот вопрос:
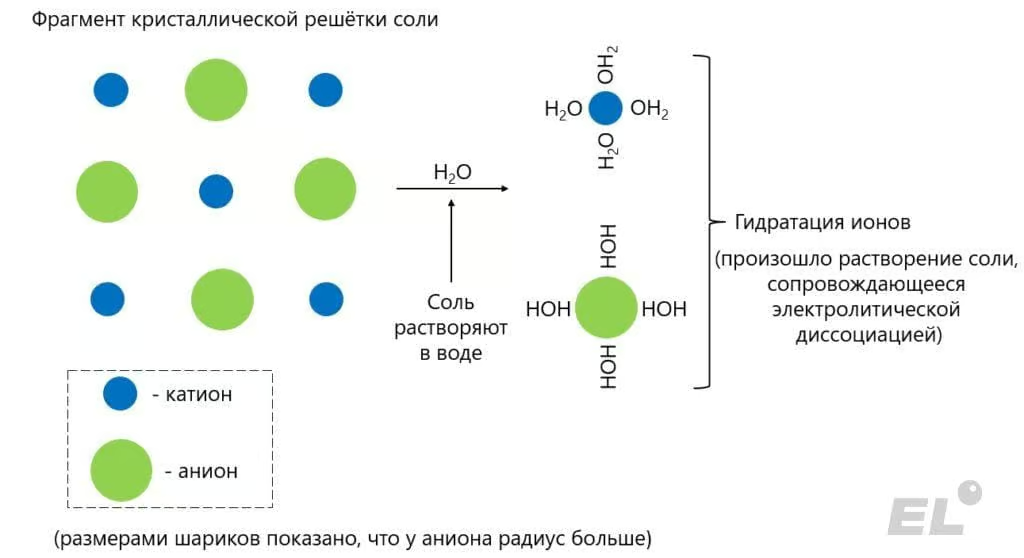
У соли ионная решётка – в узлах решётки располагаются катионы и анионы. Вода сама по себе полярная молекула – на одном её конце сосредоточен отрицательный заряд, а на другом её конце – водородах – уже положительный заряд, поэтому вода может прекрасно взаимодействовать с ионами. К чему это ведёт? Вода прямо-таки разрушает ионную решётку соли, давая отдельные катионы и анионы, из которых состоит решётка соли. Причём эти ионы покрыты гидратной шубой, которая очень выгодная и компенсирует затраты энергии, которые пошли на разрушение решётки. Обычно это всё записывается как реакция электролитической диссоциации соли:
NaCl = Na+ + Cl—
Zn(NO3)2 = Zn2+ + 2NO3—
А что происходит дальше? Катионы и анионы могут вступать в химическую реакцию с молекулами воды, но какое условие для этой реакции? Давайте, возьмём хлорид натрия, возможны следующие реакции:
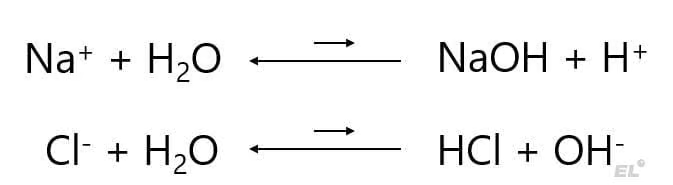
Однако в виду того, что гидроксид натрия и соляная кислота – сильные электролиты – равновесие практически полностью смещено в сторону исходные веществ, то есть ионы не реагируют с водой, или, что то же самое, не подвергаются гидролизу.
Изменим ситуацию и заменим NaCl на NaF:
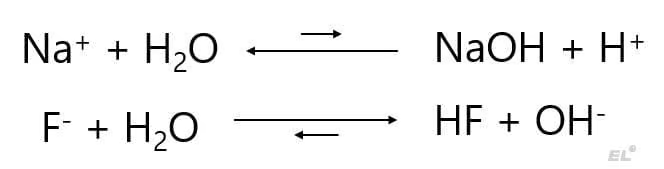
Ситуация изменилась: HF – кислота слабая, поэтому фторид-анион подвергается гидролизу и в растворе появляется избыток гидроксид-ионов OH—. Можем сформулировать интересное правило:
В прошлом примере мы увидели, что при помещении твёрдого NaF в воду, происходит разрушение кристаллической решётки соли, гидратация ионов, а затем фторид-ион ещё может реагировать с водой, давая избыток анионов OH— в растворе. Как мы можем количественно описывать количественное соотношение между ионами H+ и OH— в растворе, ну, вообще, принципиально возможны 3 ситуации:
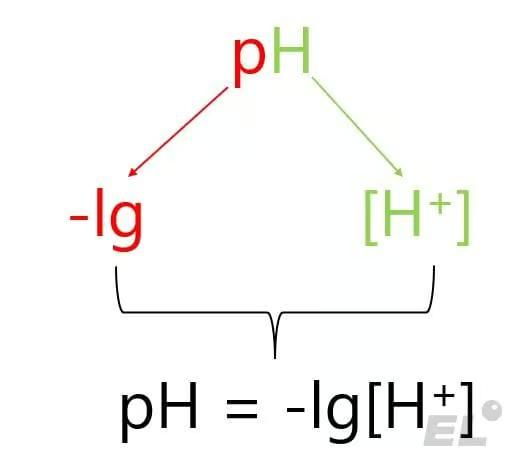
Речь идёт именно о молярной концентрации. Для того, чтобы удобно классифицировать (количественно) среду вопроса ввели водородный показатель pH, который представляет собой десятичный логарифм от концентрации ионов водорода в растворе, взятый с обратным знаком:
pH = -lg[H+]
Где lg – логарифм по основанию 10, [H+] – концентрация ионов водорода, теперь становится понятным обозначение pH:
Запоминать связь pH с средой раствора не придётся, для этого на ЕГЭ даются следующие справочные данные (это всё актуально для температуры 25 градусов Цельсия и давления 1 атмосфера):

Ну всё, в целом, мы готовы утвердить общее правило определения среды раствора:
Разберём типовые примеры определения среды растворов солей, кислот и щёлочей.
| Вещество | Комментарий | Среда раствора |
| NaCl | Не подвергается гидролизу | Нейтральная |
| NaF | Гидролиз по аниону | Слабо щёлочная |
| Zn(NO3)2 | Гидролиз по катиону | Слабо кислая |
| H2SO4 | Сильная кислота | Сильно кислая |
| NaOH | Сильное основание (щёлочь) | Сильно щёлочная |
| NaHCO3 | Гидролиз по аниону | Слабо щёлочная |
| NaHSO4 | Серная кислота – сильная, поэтому кислотный остаток диссоциирует HSO4— = H+ + SO42- | Слабо кислая |
| Al2S3 | Гидролиз и по катиону, и по аниону (совместный гидролиз) | Произойдёт реакция полного необратимого гидролиза: Al2S3 + 6H2O = 2Al(OH)3 + 3H2S |
Как же визуально определять какая среда у раствора? Очень просто – поместить в него вещество, которое меняет свою окраску в зависимости от среды раствора – такие вещества называются индикаторами:
| Индикатор | Окраска индикатора в кислой среде | Окраска индикатора в нейтральной среде | Окраска индикатора в кислой среде |
| Фенолфталеин | бесцветный | бесцветный | малиновый |
| Метилоранж | красный | оранжевый | жёлтый |
| Лакмус | красный | фиолетовый | синий |
Резюме
Задание 1. Задача №21 (из тестовой части)
Расположите водные растворы веществ, обладающие одинаковой молярной концентрацией, по возрастанию значения pH их водных растворов:
3124
Задание 2. Задача №21 (из тестовой части)
Расположите водные растворы веществ, обладающие одинаковой молярной концентрацией, по убыванию значения pH их водных растворов:
3214
Задание 3. Задача №31 (из открытой части)
Гидроксид алюминия растворили в соляной кислоте. К полученному раствору прилили раствор гидрокарбоната натрия, при этом одновременно выпал белый и осадок и выделился газ. Газ поглотили минимально возможным количеством щёлочи, а осадок растворили в щёлочи. Напишите уравнения четырёх описанных реакций:
Была ли эта статья тебе полезной?
Всё ли было понятно? Оставляй обратную связь, мы это ценим
Тогда заполняй все поля и жди сообщения от нашего менеджера из отдела заботы



Обязательно заполните все поля, иначе мы не сможем точно подобрать подготовку