Ионный и радикальный механизмы в органической химии
3051
В органической химии принципиально возможны два механизма реализации реакций:
- Радикальный механизм – промежуточными частицами в реакции являются радикалы;
- Ионный механизм – промежуточными частицами в реакции являются ионы.
Начнём с радикального механизма на примере реакции галогенирования метана. Как известно, реакции галогенирования алканов проводят при освещении. Зачем это делают? Энергия света раскачивает электроны связи галоген – галоген, приводя к разрыву связи:
Cl-Cl = Cl● + Cl●
Где точка «●» обозначает неспаренный электрон. Эта стадия называется стадией инициации – в ходе неё происходит генерация радикалов в системе. Вообще генерировать радикалы можно по-разному:
- Действуя светом – энергия света идёт на разрыв связей;
- Повышенная температура – тепловая энергия идёт на разрыв связей;
- Добавление дополнительных активных частиц, которые в ходе химической реакции генерируют радикалы.
Образовавшиеся частицы Cl● атакуют метан:
H3C-H + Cl● = H3C● + H-Cl
Это стадия развития цепи. Далее происходит обрыв цепи, в ходе которого радикалы гибнут:
H3C● + Cl● = H3C-Cl
Спрашивается, зачем расписывать этот радикальный механизм так подробно, если можно сходу написать конечную реакцию:
CH4 + Cl2 = CH3Cl + HCl
Ответ очень прост: для более сложных алканов определять продукт галогенирования не так легко. Например, какой продукт преимущественно будет образовываться в результате бромирования пропана? Посмотрим на стадию развития цепи, могут образоваться следующие радикалы:
CH3CH2CH3 + Br● = CH3CH●CH3 + HBr
CH3CH2CH3 + Br● = CH3CH2CH2● + HBr
Радикал CH3CH●CH3 даст вторичный бромалкан CH3CHBrCH3, а CH3CH2CH2● даст первичный алкилбромид CH3CH2CH2Br. Однако радикал CH3CH●CH3 более стабильный (у него сразу две метильных группы «размазывают» этот неспаренный электрон на углероде), поэтому охотнее будет образовываться и преимущественным продуктом будет именно CH3CHBrCH3. То есть:
- Механизм – главный ключик к понимаю, какой продукт будет преимущественно образовываться;
- Механизм реакции позволяет глубже понять, как именно реакция идёт.
Посмотрим теперь на ионный механизм. И начнём с примера: реакции пропена CH3-CH=CH2 с HBr:
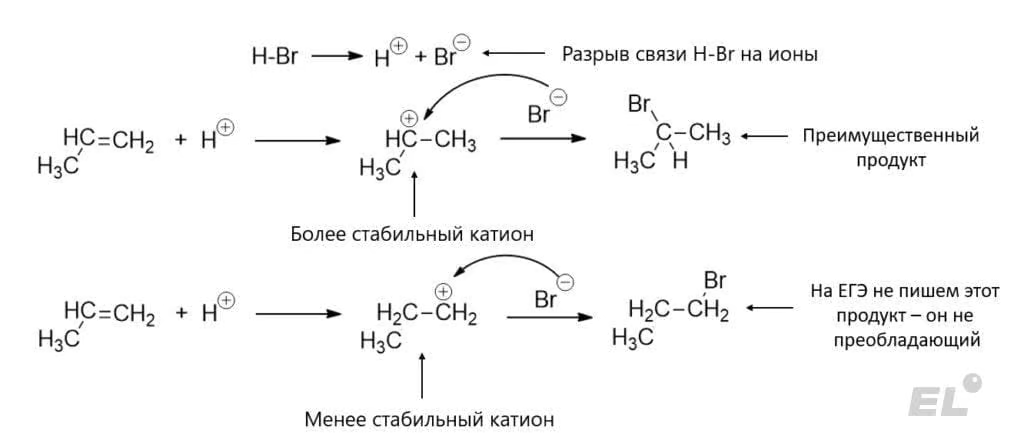
На первой стадии происходит разрыв HBr на отдельные ионы. На следующей стадии катион H+ атакует двойную связь, причём он может его атаковать сразу с двух концов, но будет реализовываться именно та атака, которая приводит к образованию наиболее стабильного катиона. Получаем конечный преимущественный продукт – 2-бромпропан CH3CHBrCH3. Данный механизм объясняет правило Марковникова:
- Атом водорода в реакциях присоединения по кратной связи идёт преимущественно по наиболее гидрогенизированному атому углерода.
Этот же механизм можно использовать для исключений из правила Марковникова. Поставим вместо метильной группы трихлорметильную, реакция CCl3-CH=CH2 + HCl:
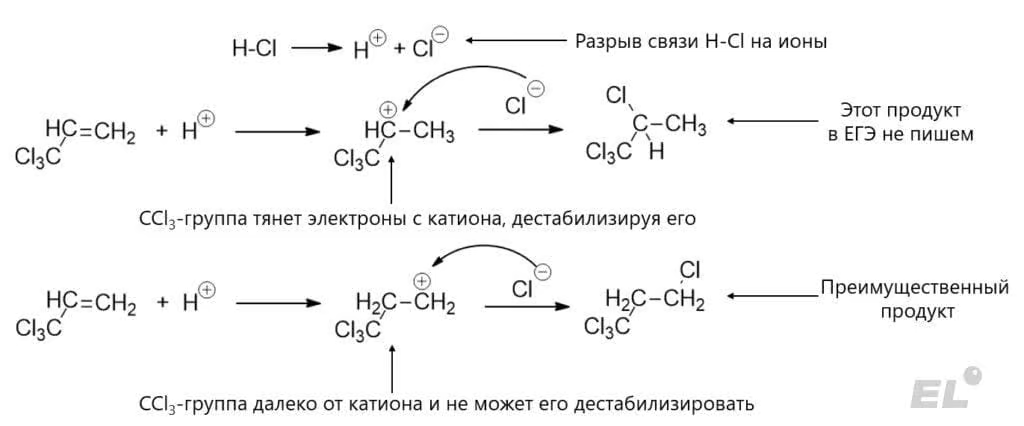
Тут уже преимущественным продуктом будет CCl3-CH2-CH3. Есть ещё более занятный пример: мы уже писали выше, что инициатором радикальных реакций могут выступать активные вещества, это можно использовать, чтобы сменить механизм с ионного на радикальный. Это происходит при попытке присоединить HBr к CH3-CH=CH2 в присутствии пероксида водорода H2O2. Пероксид водорода содержит неустойчивый пероксидный мостик HO-OH, который может разрушаться, давая радикалы (стадия инициации):
HO-OH = HO● + ●OH
Далее идёт стадия развития цепи:
HO● + HBr = H2O + Br●
И уже радикал брома атакует пропен:
CH3-CH=CH2 + Br● = CH3-CH●-CH2Br
Получаем конечный продукт:
CH3-CH●-CH2Br + HBr = CH3-CH2-CH2Br + Br●
Резюме:
- Реакции в органической химии могут протекать по ионному или радикальному механизму;
- Радикальный механизм прекрасно объясняет, почему в алканах в реакциях галогенирования замещение преимущественно идёт у атома углерода, окружённого максимальным числом алкильных заместителей;
- Ионный механизм может объяснить правило Марковникова и исключения (наличие акцепторной группы в молекуле, перекисный эффект Хараша) из него в реакциях присоединения по кратным связям.
Примеры задач на эту тему:
Задание 1. Задача №17 (из тестовой части)
Выберите все реакции, протекающие по радикальному механизму:
- CH3-CH=CH2 + HCl
- CH3-CH=CH-CH3 + HBr
- CH3-CH=CH-CH3 + HBr (в присутствии перекиси водорода)
- CH4 + Br2 (на свету)
- C2H4 + Cl2
17
Задание 2. Задача №17 (из тестовой части)
Выберите все реакции, протекающие по ионному механизму:
- CH3-CH=CH2 + HCl
- CH3-CH=CH2 + HBr (в присутствии H2O2)
- CH3-CH=CH-CH3 + HBr
- CH4 + Br2 (на свету)
- C2H6 + Cl2 (на свету)
13
Задание 3. Задача №32 (из открытой части)
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
CH3-CH=CH2 → X1 → CH3-CH-CH2OH → X2 → X3 → CH3-CH=CH2
- CH3-CH=CH2 + HBr = CH3-CH2-CH2Br (в присутствии H2O2)
- CH3-CH2-CH2Br + NaOH (водный) = CH3-CH2-CH2OH + NaBr
- CH3-CH2-CH2OH = CH3-CH=CH2 + H2O
- CH3-CH=CH2 + HBr = CH3-CHBr-CH3
- CH3-CHBr-CH3 + NaOH (спиртовой) = CH3-CH=CH2 + NaBr + H2O
Определения:
- Радикалы – очень активные частицы, содержащие один или несколько неспаренных электронов.
- Ион – положительно (катион) или отрицательно (анион) заряженная частица.
- Акцепторная группа – группа, содержащая сильно электроотрицательные атомы, легко стягивающая в молекуле электроны на себя.
- Перекисный эффект Хараша – изменение механизма присоединения по кратной связи с ионного на радикальный при протекании реакции в присутствии пероксида водорода H2O2.

Хочешь начать готовиться, но остались вопросы?
Заполни форму, и мы подробно объясним, как устроена подготовка к ЕГЭ и ОГЭ в ЕГЭLAND













