Обратная связь
Была ли эта статья тебе полезной?
Всё ли было понятно? Оставляй обратную связь, мы это ценим
Не трать свое время на поиски нужной инфы, пользуйся нашим учебником.
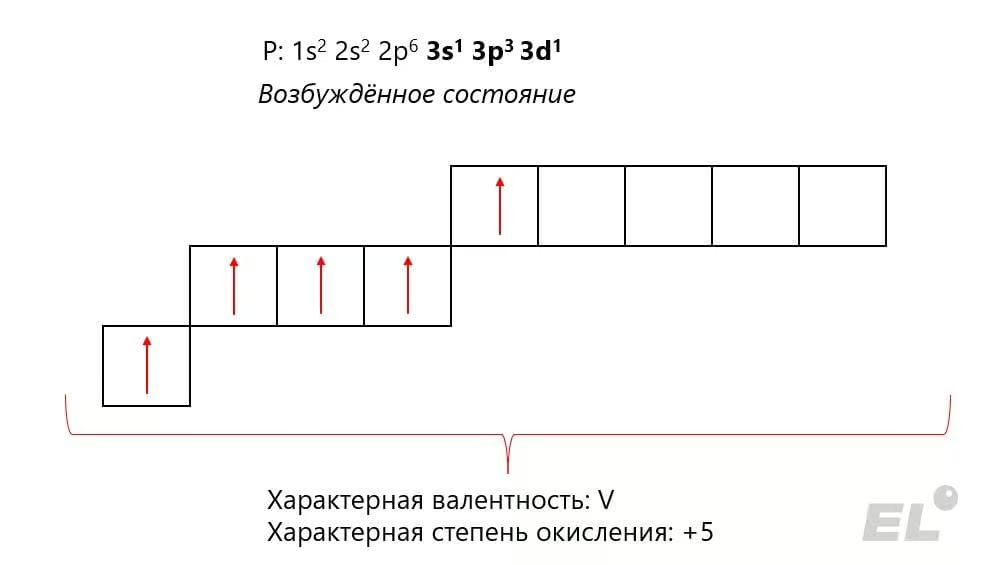
Фосфор – элемент пятой группы главной подгруппы. Электронное строение атома фосфора в отличие от азота позволяет ему в возбуждённом состоянии проявлять не только степень окисления, равную +5, но и валентность V:
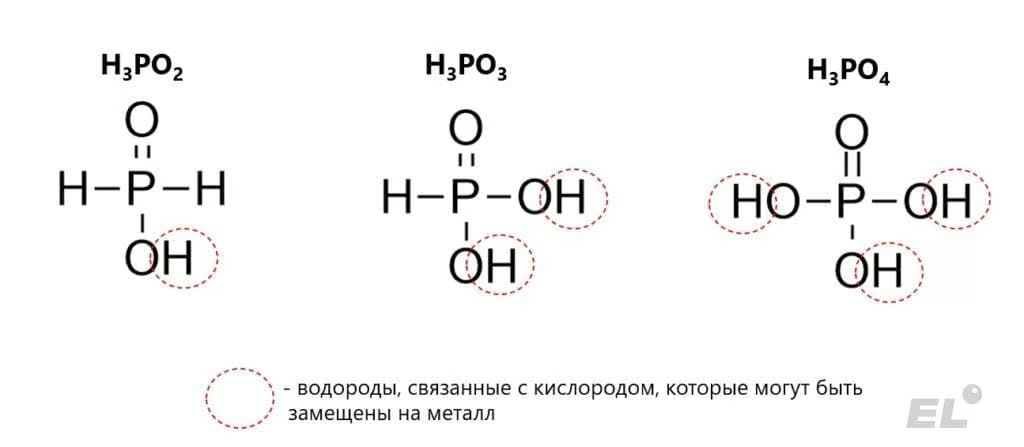
Перечислим другие характерные степени окисления в таблице:
| Степень окисления | -3 | +1 | +3 | +5 |
| Пример вещества | Фосфин PH3 | Фосфорноватистая кислота H3PO2 | Фосфористая кислота H3PO3 | Фосфорная кислота H3PO4 |
Отметим следующее:
Фосфор в степени окисления 0 может проявлять как восстановительные свойства, так и окислительные:
| Свойство | Пример реакции |
| Фосфор — восстановитель | Горение в избытке кислорода: 2P + 5O2 = 2P2O5 |
| Фосфор — восстановитель | Горение в избытке хлора: 2P + 5Cl2 = 2PCl5 |
| Фосфор — восстановитель | Реакция с иодом даёт трииодид фосфора: 2P + 3I2 = 2PI3 Это связано с тем, что пентаиодид фосфора неустойчив и разлагается: PI5 = PI3 + I2 |
| Фосфор — восстановитель | Реакция с кислотами-окислителями: 2P + 5H2SO4 = 2H3PO4 + 5SO2 + 2H2O |
| Фосфор – и окислитель, и восстановитель | Реакция диспропорционирования в щёлочи: 4P + 3NaOH + 3H2O = 3NaH2PO2 + PH3 |
| Фосфор — окислитель | Получение фосфидов металлов: 3Ca + 2P = Ca3P2 |
| Получение фосфора | Восстановление фосфата кальция углём в присутствии кремнезёма: Ca3(PO4)2 + 5C + 3SiO2 = 3CaSiO3 + 5CO + 2P |
В дополнение, запишем следующие пункты:
PCl5 + 4H2O = H3PO4 + 5HCl
Ca3P2 + 6HCl = 3CaCl2 + 2PH3
5PH3 + 8KMnO4 + 12H2SO4 = 8MnSO4 + 4K2SO4 + 5H3PO4 + 12H2O
Перейдём, наконец, к свойствам соединений фосфора в степени окисления +5. Оксид фосфора(V), как и фосфорная кислота H3PO4, проявляют кислотные свойства, реагируя с основаниями:
P2O5 + 3CaO = Ca3(PO4)2
3NaOH + H3PO4 = Na3PO4 + 3H2O
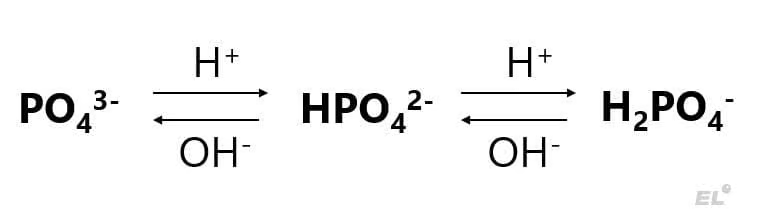
При написании реакций с участием фосфорной кислоты всегда стоит внимательно смотреть, какой реагент находится в избытке, поскольку возможно образование кислых солей гидрофософатов HPO42- и дигидрофосфатов H2PO4— в избытке фосфорной кислоты:
2NaOH + H3PO4 = Na2HPO4 + 2H2O
NaOH + H3PO4 = NaH2PO4 + H2O
Кислые и средние соли фосфора могут переходить в друг друга по следующей схеме:
Также возможны следующие реакции ионного обмена, представляющие собой вытеснение фосфорной кислоты более сильными кислотами или осаждение фосфатов:
2Na3PO4 + 3H2SO4 = 3Na2SO4 + 2H3PO4
3LiCl + Na3PO4 = Li3PO4 + 3NaCl
В завершение, отметим некоторые специфические свойства оксида фосфора(V):
P2O5 + 3H2O = 2H3PO4
3Na2SO3 + P2O5 = 2Na3PO4 + 3SO2
Задание 1. Задача №1 (первая часть ЕГЭ)
Из указанных в ряду элементов:
1) P 2) O 3) N 4) F 5) As
Выберите два элемента, которые имеют высшую валентность, равную V.
1 5
Задание 2. Задача №6 (первая часть ЕГЭ)
Даны две пробирки с соляной кислотой. К первой пробирке добавили раствор вещества X, ко второй – твёрдое вещество Y. В результате в первой пробирке не наблюдали видимых изменений, а во второй пробирке – растворение твёрдого вещества. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
14
Задание 3. Задача №31 (вторая часть ЕГЭ)
Фосфор сожгли в избытке кислорода. Полученное твёрдое вещество вступило в реакцию с оксидом кальция. Продукт реакции прореагировал со смесью углерода и диоксида кремния, что дало простое вещество, растворимое в щёлочи.
Была ли эта статья тебе полезной?
Всё ли было понятно? Оставляй обратную связь, мы это ценим
Тогда заполняй все поля и жди сообщения от нашего менеджера из отдела заботы



Обязательно заполните все поля, иначе мы не сможем точно подобрать подготовку