Галогены
2064
Галогены – элементы седьмой группы главной подгруппы, из которых будут наиболее интересны:
- F – фтор
- Cl – хлор
- Br – бром
- I – иод
Исходя из электронного строения атомов галогенов определим характерные степени окисления:
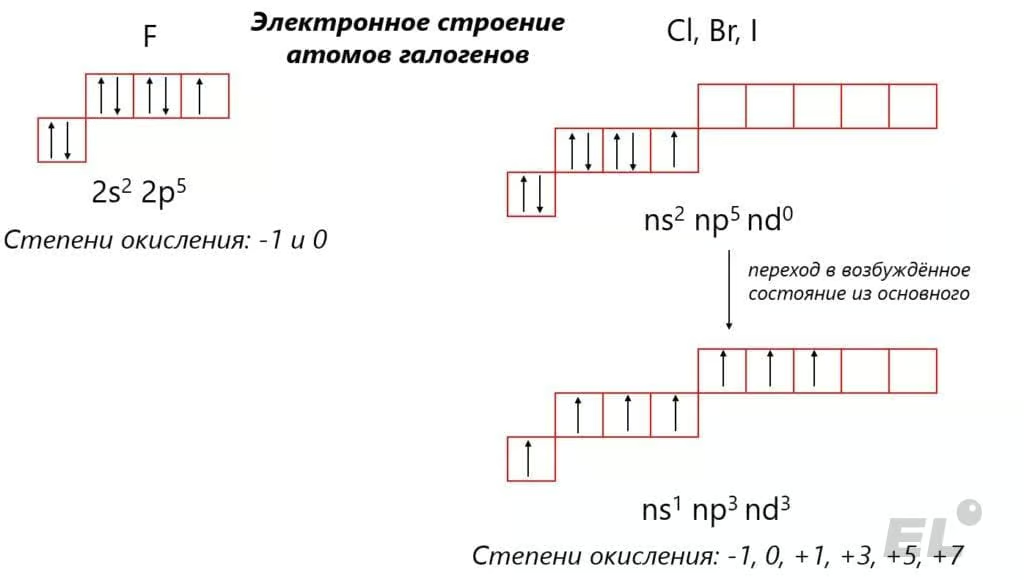
Как видно, фтор несколько выделяется на фоне остальных галогенов, так как не имеет низколежащего d-подуровня, куда могут «распариваться» электроны, из-за чего имеет весьма ограниченный набор степеней окисления: -1 и 0. Оставшиеся галогены уже имеют вакантный d-подуровень и могут «распаривать» электроны на него при переходе в возбуждённые состояния, за счёт чего набор степеней окисления простирается в диапазоне: -1, 0, +1, +3, +5 и +7. Этот набор легко запомнить: галогены в седьмой (нечётной) группе, поэтому для них и характерны нечётные степени окисления. Кстати, уникальность фтора ещё заключается в том, что он является самым электроотрицательным атомом и окислить его можно лишь электролизом расплавов фторидов:
2NaF (расплав) = 2Na + F2
В растворе анодному окислению будет подвергаться не фторид-ион, а вода, что даёт O2 вместо F2. С остальными галогенидами таких проблем не возникает и они могут быть получены электролизом как расплава, так и раствора:
CuCl2 (раствор) = Cu + Cl2
Или с помощью обычных окислительно-восстановительных реакций:
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
Перейдём к обсуждению конкретных степеней окисления.
Степень окисления 0
Речь идёт о простых веществах – двухатомных молекулах галогенов:

Изменение агрегатного состояния галогенов закономерно: с увеличением атомной массы галогенов повышаются температуры кипения и плавления, от сюда и видим переход от газообразного состояние (в случае фтора и хлора) к твёрдому иоду через жидкий бром. Кстати, для иода характерен интересный фазовый переход: сублимация. Фтор проявляет исключительно окислительные свойства, остальные галогены как окислительные, так и восстановительные. Приведём примеры:
| Реагент | Реакция |
| Вода | Вода сгорает в хлоре: H2O + 2F2 = OF2 + 2HF Остальные галогены в ней диспропорционируют, причём при пониженной температуре образуются кислоты типа HЭO, а с нагреванием HЭO3 (Э = Cl, Br): Cl2 + H2O = HClO + HCl (на холоде) 3Cl2 + 3H2O = HClO3 + 5HCl (при нагревании) Это связано с тем, что при нагревании кислоты типа HЭO сами диспропорционируют: 3HЭO = 2HCl + HЭO3 |
| Щёлочь | В случае фтора происходит окисление щёлочи: 2KOH + 2F2 = OF2 + 2KF + H2O Остальные галогены диспропорционируют в щёлочи: 2KOH + Br2 = KBr + KBrO + H2O (без нагревания) 6KOH + 3Br2 = 5KBr + KBrO3 + 3H2O (с нагреванием) С иодом реакция идёт до KIO3 в виду неустойчивости KIO. Очень похоже идут реакции с карбонатами, так как они обладают слабощёлочной реакцией среды: 3K2CO3 + 3Cl2 = 5KCl + KClO3 + 3CO2 |
| Восстановители | Хлорная и бромная вода проявляют сильные окислительные свойства: SO2 + Cl2 + H2O = H2SO4 + 2HCl SO2 + Br2 + 4NaOH = Na2SO4 + 2NaBr + 2H2O |
| Галогениды | Тут действует правило: «более сильный по окислительной способности галоген вытесняет более слабый по окислительной способности галоген из галогенидов»: 2NaBr + Cl2 = 2NaCl + Br2, так как хлор проявляет более сильные окислительные свойства чем бром |
| Кислоты-окислители | Иод I2 проявляет сильные восстановительные свойства и может растворяться в концентрированной серной кислоте и азотной кислоте: I2 + 10HNO3 = 2HIO3 + 10NO2 + 4H2O |
Степени окисления -1, +1, +3, +5, +7
Начнём со степени окисления -1:
- Характерные представители: галогеноводородные кислоты HЭ и соли-галогениды MЭx, где x – валентность металла M, Э = F, Cl, Br, I;
- Для фтороводородной (плавиковой) кислоты HF характерны исключительно кислотные свойства, соли плавиковой кислоты – фториды могут вступать в реакции ионного обмена:
Ca(NO3)2 + 2NaF = CaF2 + 2NaNO3
- Для хлороводородной (соляной) HCl, бромоводородной HBr, иодоводородной HI кислот характерны как кислотные, так и восстановительные свойства. Их соли: хлориды, бромиды и иодиды также проявляют восстановительные свойства и могут вступать в реакции ионного обмена, причём хлориды наименее подвержены окислению, например:
NaCl + H2SO4 = NaHSO4 + HCl (хлор в степени окисления -1 не окисляется)
2NaBr + 3H2SO4 = 2NaHSO4 + Br2 + SO2 + 2H2O (бром в степени окисления -1 окисляется до 0)
- HF – слабая кислота, остальные являются сильными кислотами:
NaF + HCl = NaCl + HF
Для фтора положительных степеней окисления нет, для остальных галогенов (на примере хлора):
| +1 | +3 | +5 | +7 | |
| Кислота | Хлорноватистая HClO (слабая) | Хлористая HClO2 (слабая) | Хлорноватая HClO3 (сильная) | Хлорная HClO4 (сильная) |
| Соль | Гипохлориты NaClO | Хлориты NaClO2 | Хлораты NaClO3 | Перхлораты NaClO4 |
| Свойства | Преимущественно окислительные | Преимущественно окислительные | Преимущественно окислительные | Окислительные |
Приведём примеры кислотных и окислительных свойств хлорной кислоты HClO4:
NaOH + HClO4 = NaClO4 + H2O
8NO + 3HClO4 + 4H2O = 8HNO3 + 3HCl
Заключительный пример — окисление хрома хлоратом калия (бертолетовой солью) в щёлочной среде:
Cr + KClO3 + 2KOH = K2CrO4 + KCl + H2O
Резюме
- Фтор не проявляет положительных степеней окисления.
- Остальные галогены имеют устойчивые нечётные степени окисления: -1, 0, +1, +3, +5 и +7.
- Соединения галогенов в положительных степенях окисления проявляют сильные окислительные свойства.
- Галогены в степени окисления -1 проявляют ярко выраженные восстановительные свойства в случае брома и иода, хлориды подвергают окислению значительно хуже, фториды могут быть окислены только электролизом соответствующих расплавов.
- Иод может быть растворён в кислотах-окислителях.
Примеры задач на эту тему:
Задание 1. Задача №2 (первая часть)
1) Cl 2) Br 3) I 4) S 5) Te
Из указанных в ряду элементов, выберите 3 элемента, которые находятся в одной группе. Расположите указанные элементы в порядке уменьшения электроотрицательности.
1 2 3
Задание 2. Задача №3 (первая часть)
1) F 2) I 3) O 4) C 5) H
Из указанных в ряду элементов, выберите 2 элемента, которые проявляют максимальную валентность, равную I.
1 5
Задание 3. Задача №31 (вторая часть)
Хлорид натрия растворили в концентрированной серной кислоте. Выделившийся газ поместили в воду, в полученной кислоте растворили пиролюзит, наблюдая выделение жёлто-зелёного газа. Данный газ пропускали в начале через пробирку с горячей щёлочью, а затем через пробирку с раствором бромида натрия. Напишите уравнения четырёх описанных реакций.
- NaCl + H2SO4 = NaHSO4 + HCl
- MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
- 6NaOH + 3Cl2 = 5KCl + NaClO3 + 3H2O
- 2NaBr + Cl2 = 2NaCl + Br2
Определения:
- Иод – научное название для химического элемента I, в быту обычно иод называют йодом.
- Сублимация (возгонка) – явление фазового перехода из твёрдого состояние в газовое состояние, минуя жидкое состояние.
- Хлорная вода – раствор Cl2 в воде.
- Бромная вода – раствор Br2 в воде.

Хочешь начать готовиться, но остались вопросы?
Заполни форму, и мы подробно объясним, как устроена подготовка к ЕГЭ и ОГЭ в ЕГЭLAND












