Кислород
1838
Кислород – элемент второго периода, шестой группы главной подгруппы. Для кислорода как простого вещества характерны две аллотропные модификации двухатомный кислород O2 и трёхатомный озон O3. Исходя из электронного строения кислорода определим характерные степени окисления:
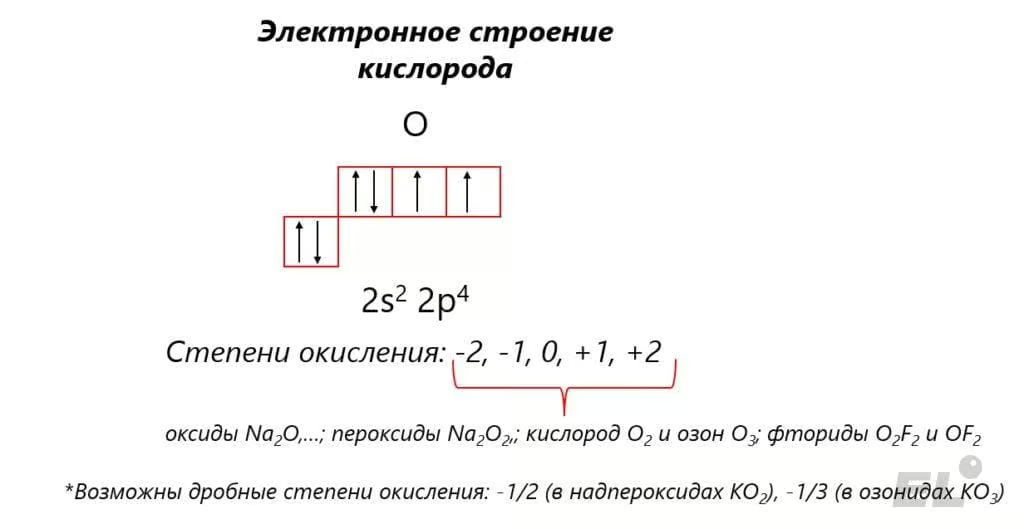
Наиболее устойчивые степени окисления: -2, -1 и 0. Стоит также обратить внимание, что у кислорода максимальная валентность не совпадает по модулю с максимальной степенью окисления: может образоваться третья донорно-акцепторная связь за счёт электронной пары кислорода на 2p-подуровне, то есть максимальная валентность кислорода равна трём (III).
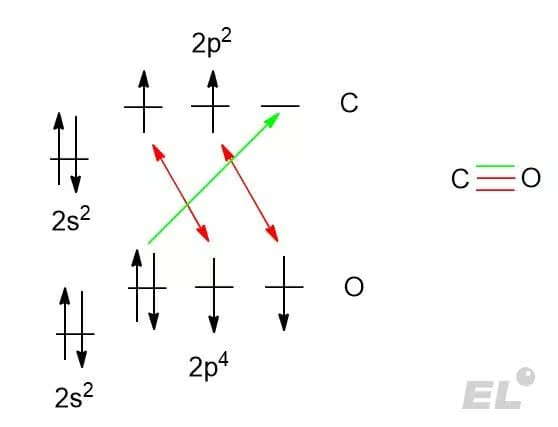
Образование донорно-акцепторной связи (зелёный цвет) на примере молекулы угарного газа
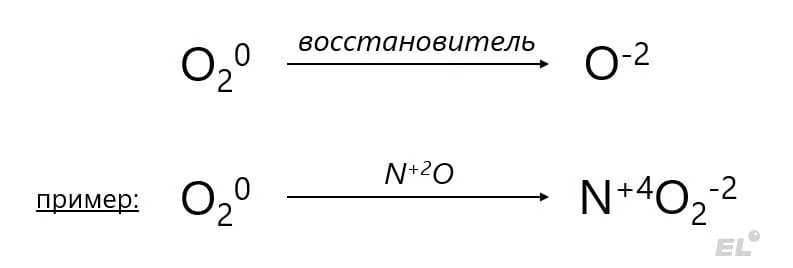
Степень окисления 0
Кислород O2, как и озон O3, являются сильными окислителями, в них «сгорает» большое число как простых веществ:
4Fe + 3O2 (избыток) = 2Fe2O3
4Li + O2 = 2Li2O
2Na + O2 = Na2O2
N2 + O2 = 2NO (под действием электрического разряда)
2Ag + O3 = Ag2O + O2
Так и сложных веществ:
4FeS2 + 11O2 (избыток) = 2Fe2O3 + 8SO2
HgS + O2 = Hg + SO2 (HgO термически неустойчив)
2SO2 + O2 = SO3 (катализатор: V2O5)
2NaI + O3 + H2O = I2 + O2 + 2NaOH (качественная реакция на озон за счёт выделение иода в качестве чёрного осадка)
Общая схема превращений:
Озон O3 является значительно более сильным окислителем в виду своей напряжённой треугольной формы:
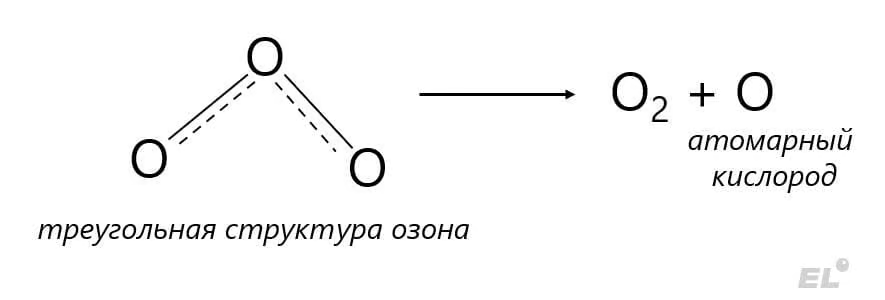
В виду такой напряжённой структуры озон относительно легко разрушается, в ходе этого высвобождается кислород в атомарном состоянии – который и обеспечивает такую сильную окислительную способность озона.
Степени окисления -2 и -1
В случае степени окисления -2 наиболее распространённые представители — это оксиды, гидроксиды и соли, в случае -1 это пероксиды:
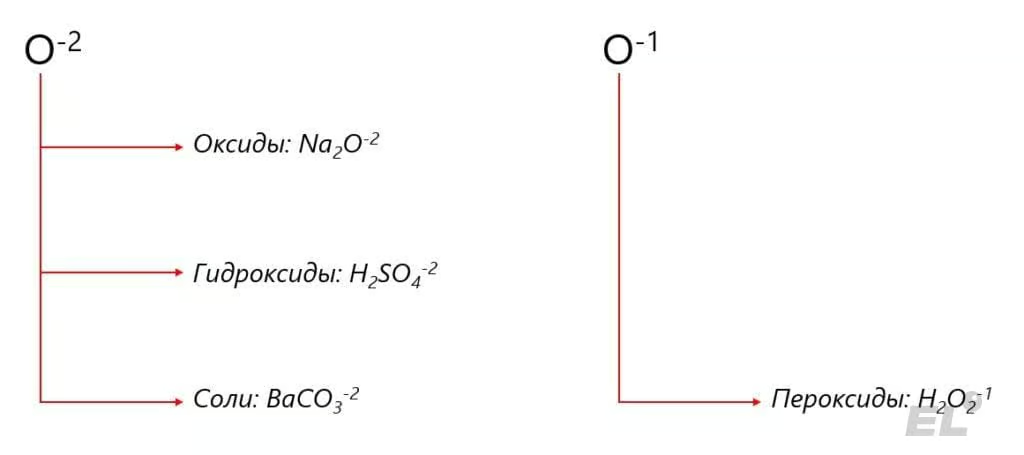
В случае кислорода в степени окисления -2 наиболее характерные типы реакций это кислотно-основные и реакции ионного обмена:
Na2O + SO3 = Na2SO4
Ca(NO3)2 + K2CO3 = CaCO3 + K2CO3
Для пероксидов, в основном, характерны реакции окислительно-восстановительного типа, причём возможны несколько ситуаций:
- Пероксид реагирует с окислителем, тогда O-1 переходит в O2;
- Пероксид реагирует с восстановителем, тогда O-1 переходит в O-2
- Пероксид диспропорционирует, давая O2 и O-2.
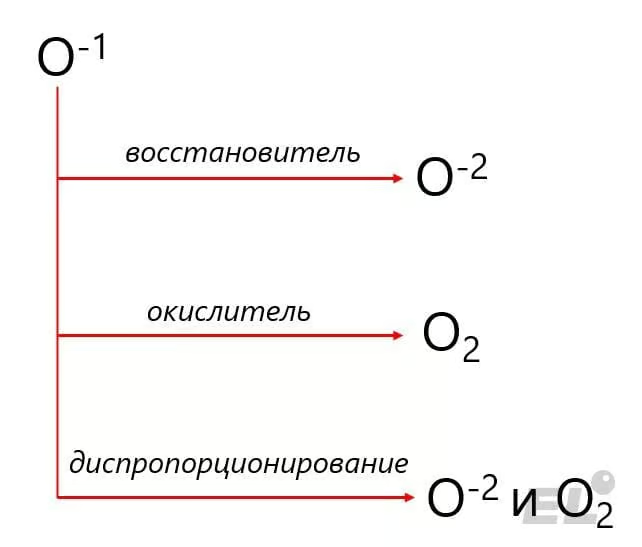
Приведём примеры данных свойств в таблице:
| Свойства | Пример реакции |
| Окислительные | Окисление иодидов в кислой среде: 2NaI + K2O2 + 2H2SO4 → I2 + Na2SO4 + K2SO4 + 2H2O |
| Восстановительные | Окисление пероксида водорода подкисленной марганцовкой: 2KMnO4 + 5H2O2 + 3H2SO4 → 2MnSO4 + K2SO4 + 5O2 + 8H2O |
| Диспропорционирование | Реакция пероксида натрия с водой без нагревания: Na2O2 + 2H2O → H2O2 + 2NaOH При нагревании перекись водорода начнёт разлагаться, вступая в реакцию диспропорционирования: 2Na2O2 + 2H2O → 4NaOH + O2 |
Способы получения кислорода
- Промышленные способы – это фракционная перегонка воздуха и электролитическое разложение воды:
2H2O = 2H2 + O2
- Лабораторные способы – это, например, каталитическое разложение бертолетовой соли или разложение пероксида водорода:
2KClO3 = 2KCl + 3O2
2H2O2 = 2H2O + O2
Резюме
- Кислород имеет 3 устойчивых степени окисления: -2, -1 и 0.
- В степени окисления 0 как кислород O2, так и озон O3, проявляют сильные окислительные свойства.
- Пероксиды, содержащие кислород в степени окисления -1, проявляют окислительно-восстановительную двойственность, выступая в зависимости от реагента или как окислитель, или как восстановитель.
Примеры задач на эту тему:
Задание 1. Задача №4 (первая часть)
Выберите два вещества, в которых есть донорно-акцепторная связь:
- угарный газ
- углекислый газ
- триоксид серы
- азотная кислота
- азотистая кислота
1 4
Задание 2. Задача №6 (первая часть)
В пробирку с раствором перманганата калия поместили вещество X, наблюдая выделение бесцветного газа и обесцвечивание раствора. В другую пробирку с KMnO4 было внесено вещество Y, при этом выпал осадок жёлтого цвета.
Выберите вещества X и Y, подходящие под условия задания:
- Na2S
- Na2SO3
- NaI
- H2O2
- BaSO4
41
Задание 3. Задача №29 (вторая часть)
Для выполнения задания используйте следующий перечень веществ: пероксид натрия, перманганат натрия, гидрофосфат калия, гидроксид натрия, серная кислота, фосфорная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с обесцвечиванием раствора. Известно, что в ходе реакции выделяется газ. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
5Na2O2 + 2NaMnO4 + 8H2SO4 → 5O2 + 2MnSO4 + 6Na2SO4 + 8H2O
Mn+7 + 5e = Mn+2|2| Mn+7 – окислитель
2O-1 – 2e = O20|5| O-1 – восстановитель
Определения:
- Аллотропные модификации – вещества, состоящие из одних и тех же атомов одного химического элемента, но различающиеся взаимным положением атомов.
- Горение – в общем случае, процесс взаимодействия вещества с газообразными окислителями.
- Фракционная перегонка – процесс разделения смеси на её индивидуальные компоненты, основанный на разнице в температуре кипения веществ.

Хочешь начать готовиться, но остались вопросы?
Заполни форму, и мы подробно объясним, как устроена подготовка к ЕГЭ и ОГЭ в ЕГЭLAND












