Обратная связь
Была ли эта статья тебе полезной?
Всё ли было понятно? Оставляй обратную связь, мы это ценим
Не трать свое время на поиски нужной инфы, пользуйся нашим учебником.
Во второй группе главной подгруппе нас ожидают:
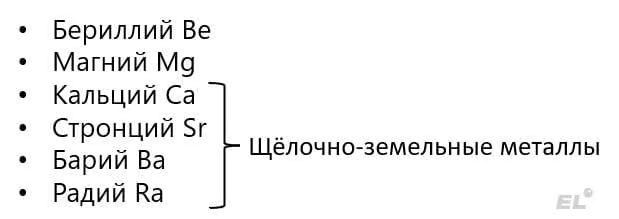
Такая неоднородность по сравнению с щелочными металлами легко осознаётся, если мы посмотрим на соответствующие гидроксиды:
Для всех этих металлов характерными степенями окисления являются 0 и +2, поскольку конфигурация внешнего слоя ns2.
Металлы второй группы главной подгруппы всё ещё являются сильными восстановителями, но чуть менее сильными восстановителями по сравнению с щелочными металлами. Химические свойства данных металлов, в целом, весьма схожи с щелочными металлами. Так, например, магний растворяется в воде лишь при нагревании (с горячей водой):
Mg + 2H2O = Mg(OH)2 + H2
Щелочные металлы, напомним, реагируют с водой значительно активнее, давая взрыв. Другие примеры химических свойств приведены в таблице:
| Реакция | Комментарий |
| Ca + 2H2O → Ca(OH)2 + H2 | Растворение кальция в воде |
| Ca + H2SO4 (разб) → CaSO4 + H2 | Реакция с кислотами становится доступной в виду не такой большой активности металлов |
| 4Mg + 5H2SO4(конц) → 4MgSO4 + H2S + 4H2O | Магний активный металл, поэтому восстановление серной кислоты идёт до сероводорода |
| Mg + Zn(NO3)2 → Mg(NO3)2 + Zn | Вытеснение менее активного (в ряду напряжений) цинка |
| Ca + C2 → CaC2 | Образование карбида (ацетиленида) кальция |
| 2Mg + O2 → 2MgO | Образование оксида магния |
| Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2 | Исключительная реакция для бериллия, поскольку он образует амфотерный гидроксид |
Также весьма полезна информация о том, в какой цвет окрашивают пламя атомы щёлочно-земельных металлов в соответствующих солях: для солей кальция пламя окрашивается в красный цвет, стронция в карминово-красный цвет, а для бария окраска пламени становится жёлто-зелёной.
Mg(OH)2, Ca(OH)2, Ba(OH)2 и так далее – основные гидроксиды ( соответствующие оксиды – также основные), поэтому возможны реакции с кислотными оксидами и гидроксидами (в случае щёлочей возможны реакции с амфотерными гидроксидами):
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
Ca(OH)2 + 2CO2 = Ca(HCO3)2
(соответствующий осадок карбоната кальция CaCO3 растворяется в избытке углекислого газа CaCO3 + CO2 + H2O = Ca(HCO3)2)
Кстати, ещё один интересный факт про CaCO3, он способен термически разлагаться (в отличие от карбонатов щелочных металлов):
CaCO3 = CaO + CO2
При написании реакций с участием гидроксидов бериллия, магния и щёлочно-земельных металлов обязательно учитываем следующие нюансы:
Mg(NO3)2 + 2NaOH = Mg(OH)2 + 2NaNO3
Mg(OH)2 + FeSO4 = реакция не идёт, так как гидроксид магния нерастворим в воде
Be(OH)2 + 2NaOH = Na2[Be(OH)4]
так и с кислотами:
Be(OH)2 + 2HCl = BeCl2 + 2H2O
Как и в случае щелочных металлов, основной способ – электролиз расплавов соответствующих солей:
CaCl2 (расплав) = Ca + Cl2
Резюме
Задание 1. Задача №9 (из тестовой части)
Задан следующая схема превращений:
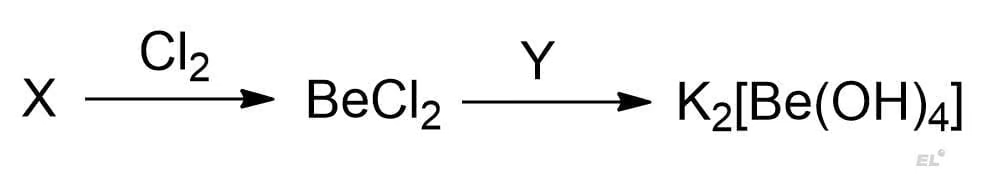
Определите неизвестные вещества X и Y:
13
Задание 2. Задача №28 (тестовая часть)
Какой объём газа можно максимально получить при растворении 15 г кальция в избытке соляной кислоты с выходом реакции 80 %? Ответ дайте в литрах с точностью до сотых.
6,72
Задание 3. Задача №31 (открытая часть)
Кальций прореагировал с углеродом, полученное бинарное вещество растворили в соляной кислоте. К образовавшемуся раствору прилили избыток щёлочи, наблюдая образование осадка. Осадок отфильтровали, поместили в воду и пропустили через него ток углекислого газа, причём после окончания пропускания газа осадок растворился. Напишите уравнения четырёх описанных реакций.
Была ли эта статья тебе полезной?
Всё ли было понятно? Оставляй обратную связь, мы это ценим
Тогда заполняй все поля и жди сообщения от нашего менеджера из отдела заботы



Обязательно заполните все поля, иначе мы не сможем точно подобрать подготовку