Обратная связь
Была ли эта статья тебе полезной?
Всё ли было понятно? Оставляй обратную связь, мы это ценим
Не трать свое время на поиски нужной инфы, пользуйся нашим учебником.
Химия неметаллов открывается с водорода – элемента первой главной группы. Это самый лёгкий атом во всей вселенной, что обуславливает его огромную распространённость в космосе, межзвёздном пространстве и так далее. У атома водорода очень интересная электронная конфигурация:
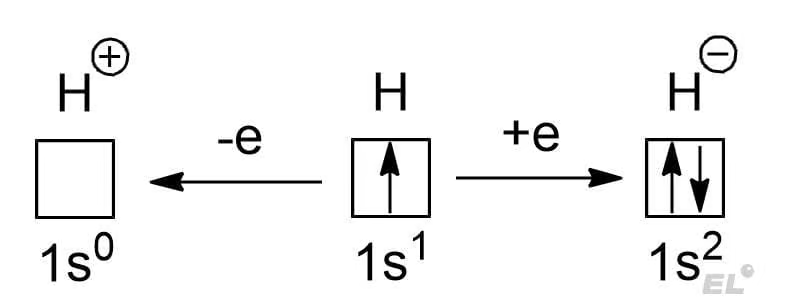
В основном состоянии он имеет единственный электрон на 1s-уровне, что открывает две возможности:
Итак, водород может встретиться в степенях окисления -1, 0, +1. Примеры представлены в таблице:
| Степень окисления | Пример вещества |
| -1 | Гидрид натрия NaH (вещество с ионной решёткой и ионной связью между катионом натрия и гидрид-анионом) |
| 0 | Молекулярный водород H2 (двухатомная гомоядерная молекула с ковалентной неполярной связью H-H) |
| +1 | Вода H2O (вещество молекулярного строения с ковалентной полярной связью O-H) |
Для водорода также характерно наличие трёх изотопов, в ядрах атома водорода может быть:
Заключительная особенность водорода – это ключевой атом в образовании водородных связей, определяющих, например, активность ферментов, нуклеиновых кислот, белков и некоторых катализаторов.
Водород более электроотрицательный чем атомы металлов, поэтому в реакции с ними образуются гидриды:
2Na + H2 → 2NaH
Ca + H2 → CaH2
Водород реагирует только с металлами первой и второй групп (главных подгрупп).
Водород – прекрасный восстановитель за счёт своей способности повышать свою степень окисления до +1. Реагирует практически со всеми неметаллами, кроме кремния и фосфора, например:
H2 + S → H2S
N2 + 3H2 → 2NH3
Последняя реакция – обратимая каталитическая реакция синтеза аммиака, на ней основано многотоннажное промышленное производство аммиака по схеме Габера-Боша. Формула водородного соединения определяется по стандартным правилам.
Водород также может восстанавливать оксиды металлов до металлов или до оксидов металлов в более низкой степени окисления:
FeO + H2 → Fe + H2O
Fe2O3 + 3H2(избыток) → 2Fe + 3H2O
Fe2O3 + H2 → 2FeO (или Fe3O4 в недостатке H2) + H2O
Также можно восстанавливать оксиды неметаллов, классический пример, реакция каталитического получения метанола:
CO + 2H2 → CH3OH
Лучший лабораторный способ – взаимодействие активного металла (но не слишком активного типа щелочных металлов, это приведёт к взрыву) с кислотой-неокислителем, например:
Zn + 2HCl → ZnCl2 + H2
В случае щелочных металлов, возможно получение водорода реакцией с водой:
2Na + 2H2O → 2NaOH + H2
Реакция очень экзотермична, поэтому проводить её стоит крайне осторожно. Также подойдут реакции амфотерных металлов или кремния с растворами щёлочей:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
Si + 2KOH + H2O → K2SiO3 + 2H2
В качестве промышленных методов получения водорода подойдут:
Можно использовать реакции электролиза водных растворов других веществ, например солей:
Na2S + 2H2O ⟶ H2 + 2NaOH + S
Задание 1. Задача №9 (задание из первой части)
Задана следующая схема превращений:
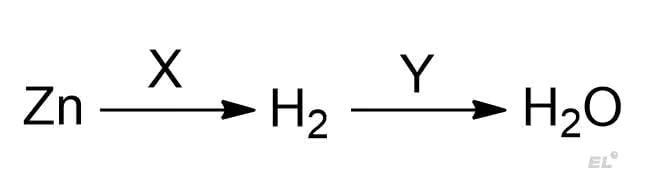
Определите, какие из указанных веществ являются веществами X и Y:
15
Задание 2. Задача № 28 (задание из первой части)
Чему равен объём водорода (при н.у.), который выделился при взаимодействии 65 г цинка с избытком разбавленной серной кислоты?
22,4 л
Задание 3. Задача №31 (задание из второй части)
Металлический натрий оставили в атмосфере водорода, причём водород был взят в недостатке. Полученный твёрдый остаток растворили в воде. Образованный раствор прилили к раствору нитрата магния, наблюдая образование осадка. Напишите молекулярные уравнения четырёх описанных реакций.
Была ли эта статья тебе полезной?
Всё ли было понятно? Оставляй обратную связь, мы это ценим
Тогда заполняй все поля и жди сообщения от нашего менеджера из отдела заботы



Обязательно заполните все поля, иначе мы не сможем точно подобрать подготовку