Кремний
1644
Кремний – элемент четвёртой группы главной подгруппы. Для кремния характерно проявление степеней окисления -4, 0, +2 и +4, что отчётливо проявляется, исходя из электронного строение соответствующих атомов:
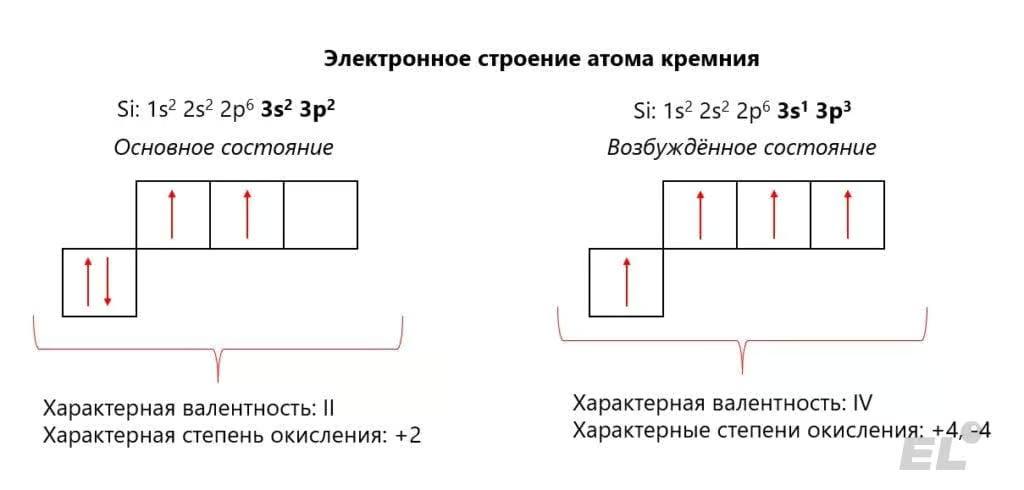
Приведём примеры веществ с данными степенями окисления в таблице:
| Степень окисления | -4 | +2 | +4 |
| Пример вещества | Силицид кальция Ca2Si | Оксид кремния(II) SiO | Оксид кремния(IV) SiO2 (кварц, кремнезём) |
Отметим важные моменты:
- Наиболее устойчивая степень окисления кремния – это +4, окислители, как правило, легко переводят кремний сразу в неё;
- Диоксид кремния SiO2 является типичным кислотным оксидом, соответствующая ему кремниевая кислота H2SiO3 является нерастворимой в воде, кроме того, SiO2 имеет атомную решётку с ковалентными-полярными связями между атомами кремния и кислорода;
- Оксид кремния(II) SiO пример несолеообразующего оксида, обладающего ярко выраженными восстановительными свойствами.
Кремний Si как простое вещество может проявлять как восстановительные свойства, так и окислительные:
| Свойство | Пример |
| Si — восстановитель | Горение в кислороде: Si + O2 = SiO2 |
| Si — восстановитель | Горение в хлоре: Si + 2Cl2 = SiCl4 |
| Si — восстановитель | Образование карборунда: Si + C = SiC |
| Si — восстановитель | Окисление водным раствором щёлочи: Si + 2NaOH + H2O = Na2SiO3 + 2H2 (окислителем являются H+1 как из воды, так и из щёлочи) |
| Si — окислитель | Реакция с активным металлом с образованием силицида: Ca + 2Si = Ca2Si |
В дополнение, отметим, что:
- Силициды подобно карбидам гидролизуются, давая газ силан SiH4:
Ca2Si + 4H2O = 2Ca(OH)2 + SiH4
Силан является хорошим восстановителем и легко сгорает в кислороде:
SiH4 + 2O2 = SiO2 + 2H2O
- Получить силан напрямую из водорода и кремния не удаётся из-за близких значений электроотрицательности соответствующих неметаллов.
Перейдём, наконец, к соединениям кремния в степени окисления +4: солям силикатам SiO32-, диоксиду кремния SiO2 и кремниевой кислоте H2SiO3. Оксид кремния(IV) и кремниевая кислота проявляют кислотные свойства, реагируя с основными оксидами и гидроксидами:
CaO + SiO2 = CaSiO3
2NaOH + H2SiO3 = Na2SiO3 + 2H2O
При написании подобных реакций ионного обмена стоит помнить, что кремниевая кислота нерастворима в воде и её можно осадить действием на силикаты более сильных кислот:
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3
Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3
Любопытны реакции осаждения нерастворимых в воде силикатов, поскольку соответствующие осадки, как правило, имеют нитеобразную форму:
MgCl2 + Na2SiO3 = MgSiO3 + 2NaCl
Перечислим особые свойства соединений кремния в степени окисления +4:
- Диоксид кремния способен вытеснять летучие оксиды из солей при сплавлении:
CaCO3 + SiO2 = CaSiO3 + CO2
- Упомянутые выше тетрагалогениды кремния подвергаются необратимому гидролизу в нейтральной и щёлочной средах:
SiCl4 + 6NaOH = Na2SiO3 + 4NaCl + 3H2O
Резюме
- Кремний – элемент четвёртой группы главной подгруппы, имеющий характерные степени окисления: -4, 0, +2 и +4.
- Наиболее распространённая степень окисления кремния — +4, в неё он переходит при действии большинства окислителей.
- Диоксид кремния SiO2 и кремниевая кислота H2SiO3 проявляют кислотные свойства, причём последняя является нерастворимой в воде.
- Оксид кремния(II) SiO является несолеообразующим оксидом.
Примеры задач на эту тему:
Задание 1. Задача №1 (в первой части)
Из указанных в ряду элементов:
1) Ca 2) C 3) Si 4) Li 5) Cu
Выберите два элемента, которые имеют ровно четыре внешних электрона.
2 3
Задание 2. Задача №29 (во второй части)
Для выполнения задания используйте следующий перечень веществ:
кремний, серная кислота (разбавленная), гидроксид калия, плавиковая кислота, сульфат бария, сульфид меди(II). Допустимо использование воды в качестве среды протекания реакции.
Из предложенного перечня выберите два вещества, которые вступают в окислительно-восстановительную реакцию с выделением горючего газа. Запишите окислительно-восстановительную реакцию, составьте электронный баланс, укажите окислитель и восстановитель.
Si + 2KOH + H2O = K2SiO3 + 2H2
Si0 – 4e = Si+4 |1| Si0 – восстановитель
4H+1 + 4e = 2H20 |1| H+1 — окислитель
Задание 3. Задача №30 (во второй части)
Для выполнения задания используйте следующий перечень веществ:
соляная кислота, кремниевая кислота, гидроксид натрия, силикат калия, плавиковая кислота, гидроксид магния. Допустимо использование воды в качестве среды протекания реакции.
Из предложенного перечня выберите два вещества, которые вступают в реакцию ионного обмена с растворением твёрдого вещества. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2NaOH + H2SiO3 = Na2SiO3 + 2H2O
2Na+ + 2OH— + H2SiO3 = 2Na+ + SiO32- + 2H2O
H2SiO3 + 2OH— = SiO32- + 2H2O
Определения:
- Кислотный оксид – оксид, которому соответствует кислота и который реагирует с основаниями.
- Несолеобразующий оксид – оксид, которому, по-сути, не соответствует никакая кислота или основание, такой оксид не вступает в кислотно-основные реакции.
- Силицид – бинарное соединение, содержащее кремний в отрицательной степени окисления.

Хочешь начать готовиться, но остались вопросы?
Заполни форму, и мы подробно объясним, как устроена подготовка к ЕГЭ и ОГЭ в ЕГЭLAND












